ГОРМОНЫ УДОВОЛЬСТВИЯ: КАК ИХ ПОЛУЧИТЬ
22 Января 2021 10:01
Количество просмотров: 15341
Дофамин, серотонин, эндорфины. Как получить побольше «гормонов удовольствия» и при этом не навредить себе?
Человеческий организм вырабатывает много веществ, вызывающих приятные ощущения: удовольствие, хорошее настроение, эйфорию. Все эти вещества биохимики называют нейромедиаторами, потому что они отвечают за передачу нервных импульсов.
Однако в просторечии многие почему-то называют дофамин, серотонин и эндорфины гормонами удовольствия.
Возникает вопрос — как человеку получить побольше этих самых «гормонов» и не навредить здоровью?
Дофамин: самое любимое
Дофамин осуществляет передачу нервных импульсов в мезолимбическом пути мозга, который отвечает за проявление удовольствия. Чем выше уровень дофамина — тем ярче ощущения.
Гормоны удовольствия
Серотонин, дофамин, эндорфины – эти вещества часто называют гормонами удовольствия.




Катехоламины (адреналин, норадреналин, дофамин) и серотонин в крови
Адреналин, норадреналин, дофамин, серотонин – это биогенные амины, являющиеся гормонами и нейромедиаторами. Их содержание значительно увеличивается в биологических жидкостях при некоторых нейроэндокринных новообразованиях. * В исследовании определяется количество каждого показателя в отдельности.
Синонимы русские
Свободные катехоламины в крови.
Синонимы английские
Catecholamines — adrenaline, norepinephrine, dopamine + serotonin.
Метод исследования
Высокоэффективная жидкостная хроматография.
Единицы измерения
Пг/мл (пикограмм на миллилитр), нг/мл (нанограмм на миллилитр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Детям в возрасте до 1 года не принимать пищу в течение 30-40 минут до исследования.

- Детям в возрасте от 1 до 5 лет не принимать пищу в течение 2-3 часов до исследования.
- Исключить из рациона авокадо, бананы, баклажаны, ананасы, сливы, помидоры, грецкие орехи в течение 72 часов до исследования.
- Не принимать пищу в течение 12 часов до исследования, можно пить чистую негазированную воду.
- Отменить (по согласованию с врачом) симпатомиметики за 14 дней до исследования.
- Полностью исключить (по согласованию с врачом) прием лекарственных препаратов в течение 24 часов перед исследованием.
- Исключить физическое и эмоциональное перенапряжение в течение 24 часов до исследования.
- Не курить в течение 2 часов до исследования.
Катехоламины – это группа сходных гормонов, вырабатываемых мозговым веществом надпочечников. Основные катехоламины: дофамин, адреналин (эпинефрин) и норадреналин. Они выбрасываются в кровь в ответ на физический или эмоциональный стресс и участвуют в передаче нервных импульсов в мозг, способствуют высвобождению глюкозы и жирных кислот в качестве источников энергии, расширению бронхиол и зрачков. Норадреналин сужает кровеносные сосуды, повышая кровяное давление, а адреналин учащает сердцебиение и стимулирует обмен веществ. После завершения своего действия эти гормоны расщепляются на физиологически неактивные вещества (гомованилиновую кислоту, норметанефрин и т. д.).
Норадреналин сужает кровеносные сосуды, повышая кровяное давление, а адреналин учащает сердцебиение и стимулирует обмен веществ. После завершения своего действия эти гормоны расщепляются на физиологически неактивные вещества (гомованилиновую кислоту, норметанефрин и т. д.).
В норме катехоламины и продукты их распада присутствуют в организме в небольших количествах. Их содержание значительно возрастает на короткое время только при стрессах. Однако хромаффинные и другие нейроэндокринные опухоли могут вызывать образование больших количеств катехоламинов, что приводит к значительному повышению уровней этих гормонов и продуктов их распада в крови и моче. Это грозит длительными или кратковременными повышениями кровяного давления и, соответственно, сильными головными болями. Другие симптомы повышенного содержания катехоламинов включают в себя дрожь, повышенное потоотделение, тошноту, беспокойство и покалывание в конечностях. Кроме катехоламинов, феохромоцитомы могут синтезировать серотонин, адренокортикотропный гормон, вазоактивный интестинальный пептид, соматостатин и другие гормоны. Соответствий между размерами опухоли, уровнем катехоламинов в крови и клинической картиной не существует.
Серотонин не является катехоламином, но также относится к группе биогенных аминов с гормональной и нейромедиаторной активностью. Он синтезируется из аминокислоты триптофана и хранится в энтерохромаффинных клетках желудочно-кишечного тракта (80-95 % от общего количества), различных структурах головного мозга, тучных клетках кожи, тромбоцитах и некоторых других эндокринных органах. Серотонин понижает порог болевой чувствительности, регулирует функцию гипофиза, влияет на сосудистый тонус, свертываемость крови, моторику и секреторную активность желудочно-кишечного тракта.
Примерно 90 % хромаффинных опухолей находятся в надпочечниках. Большинство из них являются доброкачественными и не распространяются за пределы надпочечников, хотя могут продолжать расти. Без дальнейшего лечения по мере роста опухоли со временем проявления болезни иногда становятся все более тяжелыми. Повышенное кровяное давление, вызванное хромаффинной опухолью, чревато повреждением почек и сердца и даже кровоизлиянием или сердечным приступом.
В большинстве случаев эти опухоли удаляются хирургическим путем, после чего содержание катехоламинов значительно уменьшается, а связанные с опухолью симптомы и осложнения смягчаются или вовсе исчезают.
Исследование крови выявляет количество гормона на момент взятия анализа, тогда как исследование мочи – за предыдущие 24 часа.
Для чего используется исследование?
- Для диагностики хромаффинных опухолей у пациентов с соответствующими симптомами.
- Для контроля за эффективностью лечения хромаффинной опухоли, в частности после ее удаления, чтобы убедиться при отсутствии рецидивов.
Когда назначается исследование?
- При подозрении на хромаффинную опухоль.
- Если у пациента хроническая гипертония, сопровождающаяся головной болью, потливостью, учащенным пульсом.
- Когда гипертония не поддается лечению (поскольку гипертоники с хромаффинной опухолью часто устойчивы к традиционной терапии).
- Если опухоль надпочечников или нейроэндокринная опухоль была выявлена при сканировании либо если у пациента есть наследственная предрасположенность к их образованию.
- При контроле за состоянием пациентов, которые уже проходили лечение от хромаффинной опухоли.
Что означают результаты?
Референсные значения
|
Возраст |
Референсные значения, пг/мл |
|
2-11 сут. |
36.0 — 400.0 |
|
11 сут. — 4 мес. |
55.0 — 200.0 |
|
4 мес. — 1 год |
55.0 — 440.0 |
|
1-2 года |
36.0 — 640.0 |
|
2-3 года |
18. |
|
3-18 лет |
18.0 — 460.0 |
|
> 18 лет |
10.0 — 200.0 |
|
Возраст |
Референсные значения, пг/мл |
|
2-11 сут. |
170.0 — 1180.0 |
|
11 сут. — 4 мес. |
370.0 — 2080.0 |
|
4 мес. — 1 год |
270.0 — 1120.0 |
|
1-2 года |
68.0 — 1810.0 |
|
2-3 года |
170.0 — 1470.0 |
|
3-18 лет |
85.0 — 1250.0 |
|
> 18 лет |
80. |
- Дофамин: 5,6 — 44 пг/мл.
- Серотонин: 50 — 220 нг/мл.
Поскольку на результаты данного анализа способны влиять многие факторы, а хромаффинные опухоли встречаются довольно редко, показатели часто бывают ошибочно положительными. Для уверенной постановки диагноза необходимо общее обследование пациента: оценка его физического и эмоционального состояния, принимаемых им лекарств и употребляемой пищи. При установлении мешающих точности анализа факторов и их устранении анализ часто проводят повторно, чтобы выяснить, будет ли уровень катехоламинов по-прежнему высоким. Кроме того, для подтверждения результатов может быть назначен тест на метанефрин в крови и/или в моче и магнитно-резонансная томограмма опухоли.
Повышенный уровень катехоламинов у пациента, который раньше уже лечился от хромаффинной опухоли, свидетельствует о рецидиве опухоли или о том, что терапия была не совсем эффективной.
Если концентрация катехоламинов в норме, то наличие хромаффинной опухоли маловероятно. Однако эти опухоли не всегда способствуют выработке катехоламинов с постоянной интенсивностью. Если в последнее время нет обострений гипертонии, то концентрация катехоламинов может быть близкой к норме даже при имеющейся феохромоцитоме.
Однако эти опухоли не всегда способствуют выработке катехоламинов с постоянной интенсивностью. Если в последнее время нет обострений гипертонии, то концентрация катехоламинов может быть близкой к норме даже при имеющейся феохромоцитоме.
Возможные причины повышения уровня серотонина: карциноидные опухоли; медуллярный рак щитовидной железы; опухоли яичка; целиакия; эндокардит; демпинг-синдром; острая кишечная непроходимость; муковисцидоз; острый инфаркт миокарда; прием лекарств (парацетамола, диазепама, напроксена, пиндолола). Причины понижения уровня серотонина: мастоцитоз; фенилкетонурия; синдром Дауна; карциноидные опухоли прямой кишки; болезнь Хартнупа; прием лекарств (этанола, имипрамина, изониазида, сульфасалазина).
Что может влиять на результат?
- Принимаемые лекарства (ацетаминофен, аминофилин, амфетамины, препараты для подавления аппетита, кофеинсодержащие препараты, хлоралгидрат, клонидин, дексаметазон, диуретики, эпинефрин, этанол, инсулин, имипрамин, литий, метилдофа, никотин, нитроглицирин, капли в нос, трициклические антидепрессанты и сосудорасширяющие средства).

- Употребляемая пища (чай, кофе, алкоголь).
- Стрессы.
Важные замечания
- Хотя анализы на катехоламины могут помочь в диагностике хромаффинных опухолей, они не показывают, где находится опухоль, является ли она доброкачественной (хотя таких большинство), а также одна это опухоль или же их несколько.
- Количество производимых катехоламинов не обязательно соответствует размеру опухоли, хотя оно имеет тенденцию возрастать при ее увеличении.
Также рекомендуется
- Катехоламины (адреналин, норадреналин, дофамин) в моче
- Катехоламины (адреналин, норадреналин, дофамин) и их метаболиты (ванилилминдальная кислота, гомованилиновая кислота, 5-гидроксииндолуксусная кислота) в моче
- Метаболиты катехоламинов (ванилилминдальная кислота, гомованилиновая кислота, 5-гидроксииндолуксусная кислота) в моче
- Нейронспецифическая энолаза (NSE)
- Глюкоза в плазме
Кто назначает исследование?
Эндокринолог, кардиолог, педиатр, врач общей практики, хирург.
Литература
- Eisenhofer G., Siegert G, Kotzerke J, Bornstein SR, Pacak K. Current progress and future challenges in the biochemical diagnosis and treatment of pheochromocytomas and paragangliomas. Horm Metab Res. 2008 May;40(5):329-37.
- Ganim RB, Norton JA: Recent advances in carcinoid pathogenesis, diagnosis and management. Surg Oncol 2000;9: 173-179.
- Ghevariya V, Malieckal A, Ghevariya N, Mazumder M, Anand S. Carcinoid tumors of the gastrointestinal tract. South Med J. 2009 Oct;102(10):1032-40.
- Vinik AI et al. NANETS consensus guidelines for the diagnosis of neuroendocrine tumor. Pancreas. 2010 Aug;39(6):713-34.
- Pacak K et al. Pheochromocytoma: recommendations for clinical practice from the First International Symposium. October 2005. Nat Clin Pract Endocrinol Metab. 2007 Feb;3(2):92-102.
Как гормон дофамин влияет на организм и поведение человека
О том, как изменение концентрации гормона дофамина в организме человека помогает бросить курить, провоцирует возникновение игровой зависимости и шопоголизма, вызывает близорукость, а также способствует борьбе с раковыми опухолями, рассказывает отдел науки «Газеты. Ru».
Ru».
Дофамин — это активное химическое вещество, вырабатываемое головным мозгом человека, а также гормон, производящийся надпочечниками. Дофамин естественным образом вырабатывается во время процессов, от которых человек получает удовольствие, — именно поэтому это вещество используется мозгом для оценки и закрепления важных для дальнейшей жизни действий.
Агонисты дофаминовых рецепторов — вещества, которые стимулируют работу дофаминовых рецепторов и увеличивают выработку гормона, — используются для облегчения течения некоторых заболеваний, например болезни Паркинсона. Ученые проводят многочисленные исследования, направленные на выяснение роли дофамина в других процессах — формировании различных зависимостей, лечении рака и даже отказе от курения.
Бросить курить помогает ген
Наличие в ДНК человека специфического варианта гена Taq1A под названием Taq1A A2/A2 может оказывать непосредственное воздействие на способность человека отказаться от курения. Исследование международной группы ученых, возглавляемой Ма Юньлуном из Школы медицины Чжэцзянского университета, было опубликовано в ночь со вторника на среду в журнале Translational Psychiatry и журнале Nature.
Исследование международной группы ученых, возглавляемой Ма Юньлуном из Школы медицины Чжэцзянского университета, было опубликовано в ночь со вторника на среду в журнале Translational Psychiatry и журнале Nature.
Ген Taq1A A2/A2 кодирует работу дофаминовых рецепторов, тем самым изменяя степень их активности. Избыточное количество дофамина в головном мозге человека, в свою очередь, способствует формированию никотиновой зависимости — мозг начинает «осознавать», что курение приносит удовольствие, а значит, является действием, которое необходимо повторять.
Ученые проанализировали результаты 22 исследований, содержащих данные о 11 075 людях, 9487 из которых были представителями европеоидной расы. Авторы работы утверждают, что им удалось обнаружить закономерность:
люди европеоидной расы, ДНК которых обладала специфическим вариантом гена Taq1A (Taq1A A2/A2), имели гораздо больше шансов успешно справиться с никотиновой зависимостью и отказаться от курения, тем те, кто обладал генами Taq1A A1/A1 или Taq1A A1/A2.
Авторы исследования подчеркивают, что их работа нуждается в дальнейшей проверке, а применять полученные выводы в практической медицине пока рано.
Игровая зависимость — побочный эффект от лечения
Другая группа исследователей выяснила, что врачи долгое время переоценивали эффективность агонистов дофаминовых рецепторов, применяя их для борьбы с болезнью Паркинсона и психическими расстройствами.
Препараты-агонисты воздействуют на дофаминовые рецепторы, заставляя их работать более активно. Избыточное количество гормона провоцировало формирование различных психических расстройств и зависимостей.
Так, на протяжении десяти лет в 21 стране мира было зафиксировано 1580 случаев возникновения зависимостей в результате побочного действия лекарственных препаратов. Эти случаи включали в себя
628 эпизодов возникновения игровой зависимости, 465 случаев формирования гиперсексуальности и 202 случая шопоголизма. Из 1580 поставленных диагнозов 710 были обязаны своим возникновением агонистам дофаминовых рецепторов,
а оставшиеся 870 — всем остальным видам воздействующих на гормональный фон препаратов. Более подробно с исследованием можно ознакомиться в журнале JAMA Internal Medicine.
Дофамин против рака
А вот исследователи из Университета штата Огайо под руководством Суджита Басу все же советуют использовать дофамин в качестве лекарства — правда, от рака. Соответствующая статья была опубликована в журнале International Journal of Cancer.
Соответствующая статья была опубликована в журнале International Journal of Cancer.
Ученые заявили, что
применение дофамина существенно замедляет рост кровеносных сосудов в злокачественной опухоли, а это является одним из важнейших факторов ее роста, так как кровеносные сосуды обеспечивают питание ракового образования.
Кроме того, исследователи утверждают, что использование дофамина снижает негативное влияние препарата 5-фторурацила (противоопухолевое вещество, которое применяется при проведении химиотерапии) на состав крови пациента.
Нет дофамина — будет близорукость
Летом этого года ученые заявили, что сумели выяснить настоящую причину возникновения близорукости у современных подростков. Статья о работе исследователей была опубликована в журнале Nature.
Статья о работе исследователей была опубликована в журнале Nature.
В последние десятилетия близорукость приобрела характер эпидемии: в Европе и США число близоруких людей за последнее столетие более чем удвоилось, в азиатских странах ситуация еще хуже. Так, если 60 лет назад от близорукости страдали 10–20% китайцев, то сейчас их уже 90%. В Сеуле 95,6% 19-летних молодых людей близоруки.
На протяжении многих лет врачи исследовали причины возникновения миопии, которая вызывается удлинением глазного яблока и фокусированием изображения перед сетчаткой глаза, а не на ней. В процессе работы выяснилось, что ни генетика, ни привычка современных людей проводить много времени за чтением и перед мониторами электронных устройств не являются решающими причинами возникновения болезни: авторы исследования заявили, что близорукость вызывается нехваткой дневного света.
Современные люди стали проводить гораздо меньше времени на улице, и именно это провоцирует возникновение миопии, так как под воздействием яркого дневного света сетчатка глаза вырабатывает дофамин, а его нехватка и вызывает удлинение глазного яблока.
Врачи посчитали, что для сохранения хорошего зрения человеку необходимо минимум три часа в день проводить при освещении в 10 тыс. люксов (яркость солнечного света), при этом самое мощное освещение, достижимое внутри помещения, обычно не превышает 5 тыс. люксов.
Harvard Business Review Россия
Настроение, состояние и эмоции человека определяет масса факторов. Но важнейший из них — работа гормональной системы, в частности так называемых гормонов счастья, благодаря которым люди испытывают радость и интерес к жизни. Что это за гормоны, как они работают и что может стимулировать их выброс, рассказывает член-корреспондент РАН, научный руководитель Института высшей нервной деятельности и нейрофизиологии Павел Балабан.
HBR Россия: Какие гормоны называют гормонами счастья и почему?
Балабан: У нас в организме много гормонов. Но среди них есть одна группа, обладающая необычным действием, — моноамины.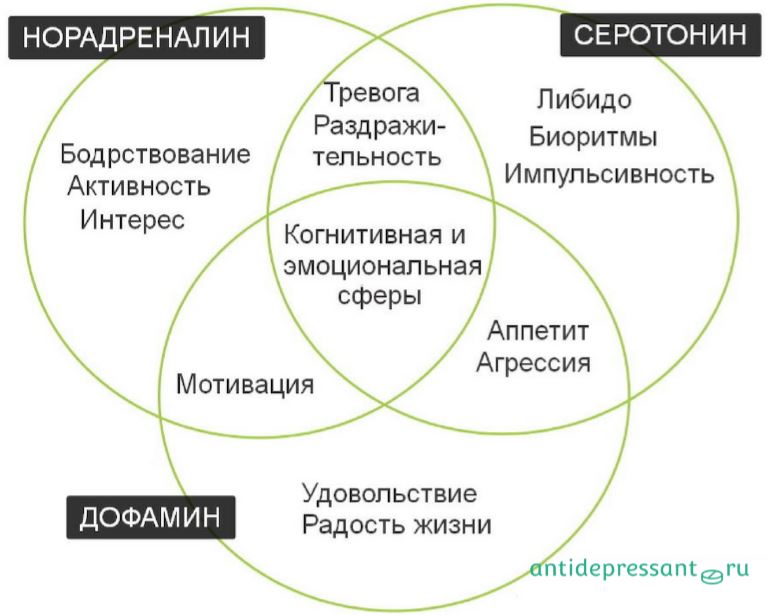 Два основных представителя этой группы, серотонин и дофамин, у всех позвоночных играют важную роль, связанную с эмоциями. Если по какой-то причине эта система нарушена, мы не можем оценивать важность событий и испытывать эмоции.
Два основных представителя этой группы, серотонин и дофамин, у всех позвоночных играют важную роль, связанную с эмоциями. Если по какой-то причине эта система нарушена, мы не можем оценивать важность событий и испытывать эмоции.
Какие гормоны участвуют в формировании той или иной эмоции, определить сложно. Например, считается, что при положительном подкреплении (позитивные эмоции) выделяется много дофамина, а серотонин, наоборот, связан с болевыми или стрессорными стимулами. Но на самом деле ни один гормон нельзя назвать ответственным за ту или иную эмоцию. Во-первых, всегда важен баланс разных гормонов, в частности серотонина и дофамина — он определяет, будет ли оценка ситуации позитивной или негативной. Во-вторых, один и тот же гормон может вызывать в нервной клетке как торможение, так и возбуждение. Все зависит от предыстории этой клетки, то есть от того, как она развивалась и какие рецепторы у нее появились в процессе развития, а какие нет. Поэтому гормоном счастья называют не только дофамин, но и серотонин: если его не хватает, человек плохо себя чувствует, его все раздражает, он негативно настроен. Положительная реакция без серотонина невозможна.
Положительная реакция без серотонина невозможна.
Серотонин влияет на работу разных областей мозга, но в первую очередь ассоциативных — тех, которые связаны с принятием решения. Когда вы принимаете решение и видите результат своей деятельности, чаще всего вы испытываете удовлетворение. Это еще одна причина, по которой серотонин можно назвать гормоном счастья.
Чем еще, кроме этих двух гормонов, определяются наши эмоции?
Считается, что баланс серотонина и дофамина важнее всего. Но, конечно, все остальные нейромедиаторы тоже участвуют в формировании эмоций. Если у вас в большом количестве вырабатывается, например, норадреналин, то баланс серотонина и дофамина сдвигается и вы чувствуете изменение настроения.
Еще одна важная система гормонов, или нейромедиаторов, — эндорфины. Их молекулярные механизмы действия не до конца исследованы. Но известно, что если система эндорфинов отрубается, то есть вы ни от чего не получаете удовольствия и вам все плохо, то метаболизм в нервной системе ухудшается. Нервные сети как бы отключаются.
Нервные сети как бы отключаются.
Как поддерживать работу эндорфинов?
Следует постоянно быть в движении, не только в физическом смысле. Нужно ставить перед собой цели, что-то делать. То есть иметь стимул, пусть и неприятный, то есть такой, от которого хочется избавиться. Это подталкивает к действиям. Если нет стимула, вы не переломите никакую ситуацию. Если он есть, то все будет хорошо. Возможности человеческого мозга не ограничены.
Ставя перед собой цель, следует помнить, что она должна быть реалистичной. Если первокурсник стремится получить Нобелевскую премию, это неправильно. Я таких студентов стараюсь не брать. Если вы уже опубликовали 20 важных статей, то можете об этом думать. А если только начинаете свою деятельность, ставьте перед собой задачу опубликовать хорошую статью. Слишком амбициозные, объективно недостижимые цели не могут стимулировать — они нужны только как обозначение горизонта.
Зависит ли характер человека от того, каких гормонов у него выделяется больше?
Количество и баланс выделяемых гормонов в разных ситуациях — и есть наш характер. Если мы легко возбудимы, значит, у нас быстро выделяются адреналин и много серотонина. Если, наоборот, слабо возбудимы, то адреналин на нуле. Но важно смотреть не на один гормон, а на все в комплексе. Потому что в одном случае у одного и того же человека серотонин — это испуг, в другом — удовольствие. Все зависит от коктейля всех остальных гормонов. То есть сказать, что конкретные гормоны напрямую влияют на характер, нельзя. И, может быть, это хорошо. Это дает нам возможность пластически на все реагировать, изменять себя и среду и, по сути, адаптироваться.
Если мы легко возбудимы, значит, у нас быстро выделяются адреналин и много серотонина. Если, наоборот, слабо возбудимы, то адреналин на нуле. Но важно смотреть не на один гормон, а на все в комплексе. Потому что в одном случае у одного и того же человека серотонин — это испуг, в другом — удовольствие. Все зависит от коктейля всех остальных гормонов. То есть сказать, что конкретные гормоны напрямую влияют на характер, нельзя. И, может быть, это хорошо. Это дает нам возможность пластически на все реагировать, изменять себя и среду и, по сути, адаптироваться.
Различаются ли мужчины и женщины в том, что касается гормонов счастья?
В целом нет. Эти гормоны играют роль в период индивидуального развития, когда формируется нервная система. Основное различие мужчин и женщин связано, естественно, с половыми гормонами, которые тоже определяют формирование нервных сетей. Сейчас есть сведения, например, о том, что разница в восприятии зрительных образов мужчинами и женщинами зависит от гормональной предыстории: нервные сети у представителей разных полов по-разному формируются и по-разному реагируют. Женщины, как правило, обращают внимание на детали в изображении, а у мужчин восприятие идет по пути ориентации в основных координатах: верх-низ, лево-право. Конечно, есть женщины, которые видят координаты, и мужчины, которые видят все детали, — но таких 10—20% популяции.
Женщины, как правило, обращают внимание на детали в изображении, а у мужчин восприятие идет по пути ориентации в основных координатах: верх-низ, лево-право. Конечно, есть женщины, которые видят координаты, и мужчины, которые видят все детали, — но таких 10—20% популяции.
Почему у некоторых людей наблюдается недостаток серотонина и, соответственно, они чувствуют себя подавленно, а у других его в избытке?
Если нет генетических поражений, то все зависит от общего состояния организма. Болезнь, неправильное или однобокое питание могут вызвать недостаток серотонина. Например, для его выработки важна аминокислота триптофан — если она не поступает в организм в нужном количестве с пищей, то серотонина будет не хватать.
Психологическое состояние человека зависит не только от количества серотонина, но и от того, как его молекулы возвращаются и используются повторно. Такое повторное использование («обратный захват») составляет особенность серотонина. Действие большинства психотропных веществ, которые направлены на борьбу с тревожными расстройствами, со стрессом, основано именно на обратном захвате молекул серотонина. Чем их больше захватывается, тем лучше психологическое состояние человека.
Действие большинства психотропных веществ, которые направлены на борьбу с тревожными расстройствами, со стрессом, основано именно на обратном захвате молекул серотонина. Чем их больше захватывается, тем лучше психологическое состояние человека.
Можно ли измерить, сколько в крови у человека серотонина и дофамина?
Их количество в нервной системе предельно мало —10 в минус 9 степени. Они довольно быстро расходуются, захватываются, связываются с рецепторами. Измерить их количество в принципе можно, такие анализы делаются. Но результат может ни о чем не говорить, так как важно не среднее количество, а присутствие в нужном месте в нужное время.
Какие внешние события обычно запускают выброс этих гормонов?
В первую очередь события, связанные с большой новизной и вызывающие испуг, страх. Они провоцируют сильный выброс не только дофамина и серотонина, но и других гормонов. Когда человек сталкивается с каким-либо стимулом, объектом, визуальным или звуковым, он в первые десятки миллисекунд оценивает опасность. Это делается на подсознательном уровне. Если, например, мы увидели что-то непривычное или услышали резкий звук, у нас сразу выделяются гормоны, прежде всего адреналин, который нас мобилизует.
Это делается на подсознательном уровне. Если, например, мы увидели что-то непривычное или услышали резкий звук, у нас сразу выделяются гормоны, прежде всего адреналин, который нас мобилизует.
Что происходит дальше, как человек реагирует?
Все индивидуально. В целом люди делятся на два типа. Еще Суворов это знал и использовал при отборе солдат в штурмовую роту. Солдат неожиданно пугали и смотрели на их реакцию. Если человек краснел, значит, у него выделялся гистамин, адреналин — и все его мышечные группы были напряжены, а силы мобилизованы, чтобы активно преодолеть опасность, — то есть он не пугался, а, скорее, испытывал агрессию. Подобная реакция в животном мире характеризует хищников: для них нападение — лучшая защита. Таких людей брали в штурмовики. Если же солдат бледнел, значит, у него, наоборот, отливала кровь и он мог упасть в обморок. Таких отправляли в тыловую роту: они были бы не просто бесполезны, но и вредны при штурме. От того, бледнеет человек или краснеет, зависит его дальнейшее поведение и эмоциональное состояние. А тип реакции на опасность, в свою очередь, во многом определяется генетической историей человека — как семейной (наследственной), так и индивидуальной — и такими особенностями, как, например, перенесенные заболевания. Скажем, в начальной стадии болезни Паркинсона система, связанная с дофамином, существенно ослабевает, сбивается баланс серотонина и дофамина и реакции человека заметно меняются. Кстати, наряду с нарушением плавности походки (дофамин контролирует в том числе движения) это является одним из идентификационных признаков раннего Паркинсона.
От того, бледнеет человек или краснеет, зависит его дальнейшее поведение и эмоциональное состояние. А тип реакции на опасность, в свою очередь, во многом определяется генетической историей человека — как семейной (наследственной), так и индивидуальной — и такими особенностями, как, например, перенесенные заболевания. Скажем, в начальной стадии болезни Паркинсона система, связанная с дофамином, существенно ослабевает, сбивается баланс серотонина и дофамина и реакции человека заметно меняются. Кстати, наряду с нарушением плавности походки (дофамин контролирует в том числе движения) это является одним из идентификационных признаков раннего Паркинсона.
Как серотонин и дофамин связаны с памятью?
Напрямую. Есть такое понятие — подкрепление. Его поднял на щит Иван Петрович Павлов. Что это такое, никто не знает — точнее, почти любой значимый стимул может служить подкреплением. Павлов описывал подкрепление как клей, который связывает очаги активности в нервной системе. И пища, и электрический шок, которые голодная собака получает после определенного сигнала, — это подкрепление. Подкрепляющий стимул, провоцируя выброс моноаминов, в том числе серотонина и дофамина, запускает молекулярные процессы формирования и хранения памяти.
И пища, и электрический шок, которые голодная собака получает после определенного сигнала, — это подкрепление. Подкрепляющий стимул, провоцируя выброс моноаминов, в том числе серотонина и дофамина, запускает молекулярные процессы формирования и хранения памяти.
Можно ли в таком случае за счет моноаминов кардинально и надолго улучшить память?
Можно. Но вы рискуете добиться противоположного эффекта: память может ухудшиться. Расскажу об эксперименте, который мы недавно описали в научной статье. Мы взяли 100 крыс, которых одинаково обучали. Из них 15 почти ничего не помнили, 15 помнили все очень хорошо, а остальные 70 учились с переменным успехом. (Такое же распределение обычно встречается у школьников: из 100 человек 15 почти всегда учатся плохо, хотя способности у них, как правило, есть.) Мы решили посмотреть, почему плохие ученики делают вид, что ничего не помнят (именно делают вид, потому что крысы очень умные животные).
Мы знаем: чтобы что-то запомнить надолго, нужно снять тормоза, которые не дают клеткам меняться. Это могут сделать моноамины, в первую очередь серотонин. Они запускают активность эпигенетических регуляторов, которые необходимы для памяти. Плохим ученикам мы сразу ввели эпигенетический регулятор, который снимал активность генетических тормозов, и увидели, что память у них действительно есть: на следующий день они все замечательно помнили без дополнительного обучения. Значит, что-то им мешало проявлять память. Выяснилось, что если система моноаминов по каким-то причинам (из-за стресса, ухудшения физиологического состояния и т. д.) плохо срабатывает и тормоза плохо сняты, то память формируется, но не работает. Как показал наш эксперимент, у плохих учеников можно очень быстро, просто введя эти регуляторы, улучшить проявление памяти. Такая память хранится ничуть не хуже, чем у самых хороших учеников.
Это могут сделать моноамины, в первую очередь серотонин. Они запускают активность эпигенетических регуляторов, которые необходимы для памяти. Плохим ученикам мы сразу ввели эпигенетический регулятор, который снимал активность генетических тормозов, и увидели, что память у них действительно есть: на следующий день они все замечательно помнили без дополнительного обучения. Значит, что-то им мешало проявлять память. Выяснилось, что если система моноаминов по каким-то причинам (из-за стресса, ухудшения физиологического состояния и т. д.) плохо срабатывает и тормоза плохо сняты, то память формируется, но не работает. Как показал наш эксперимент, у плохих учеников можно очень быстро, просто введя эти регуляторы, улучшить проявление памяти. Такая память хранится ничуть не хуже, чем у самых хороших учеников.
Однако если такой же эксперимент провести на хороших учениках — крысах, которые замечательно обучались, то у них процесс запоминания не только не улучшится, но и немного ухудшится. Дело в том, что «увеличить» память в принципе невозможно — можно улучшить возможность к запоминанию, а хорошие ученики и так используют ее по максимуму.
Дело в том, что «увеличить» память в принципе невозможно — можно улучшить возможность к запоминанию, а хорошие ученики и так используют ее по максимуму.
Вы упомянули эпигенетические регуляторы, которые необходимы для памяти. Что это такое и как их можно получить?
Эпигенетический регулятор — это вещество, которое регулирует уровень активности некоторых генов через воздействие, в том числе на генетические тормоза. Эпигенетические регуляторы бывают разными, некоторые из них содержатся в пище. Например, бутират натрия вырабатывается в кишечнике из клетчатки. Если вы едите мало овощей и фруктов, то испытываете недостаток бутирата натрия. Он также в большом количестве содержится в сливочном масле. Поскольку бутират натрия попадает в мозг из кишечника, следует помнить: от того, что творится у нас в кишечнике, зависит очень многое. Есть даже точные данные о том, что неправильная микробиота кишечника плохо сказывается на памяти.
Диета человека должна быть полноценной и разнообразной.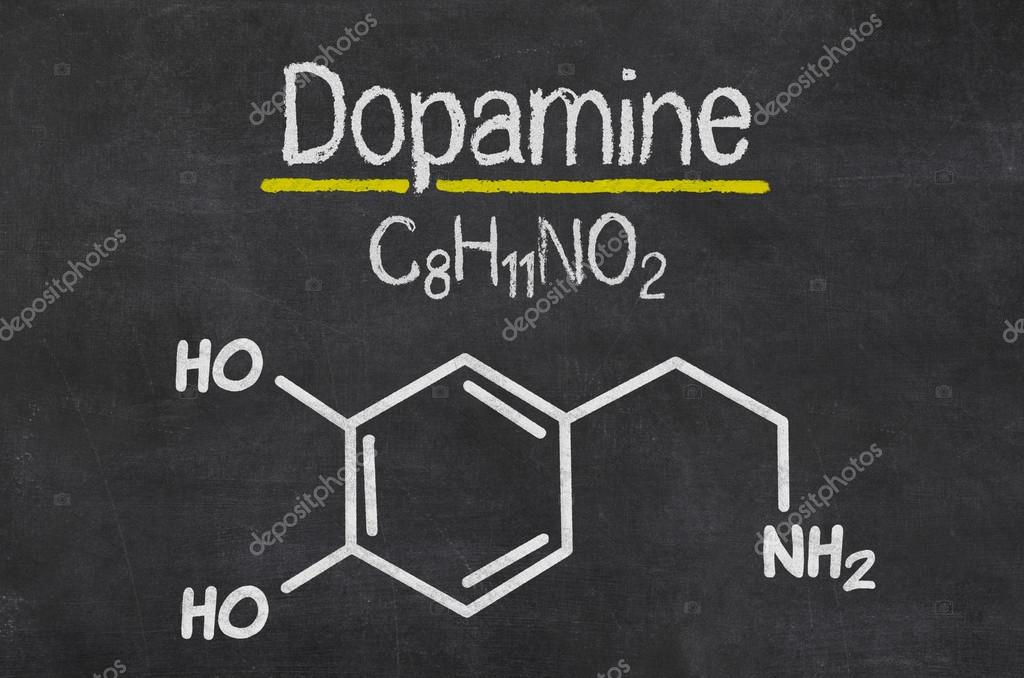 Люди — хищники, поэтому мясо для нас необходимый элемент рациона. В нем есть незаменимые аминокислоты, без которых мозг будет работать не так, как нужно. В крайнем случае мясо можно заменить растительными продуктами, например бобовыми, которые содержат часть этих аминокислот, и хотя бы рыбой.
Люди — хищники, поэтому мясо для нас необходимый элемент рациона. В нем есть незаменимые аминокислоты, без которых мозг будет работать не так, как нужно. В крайнем случае мясо можно заменить растительными продуктами, например бобовыми, которые содержат часть этих аминокислот, и хотя бы рыбой.
Что, кроме диеты, способно стимулировать выброс серотонина, дофамина и, соответственно, улучшение памяти, эмоционального состояния и т. д.?
Как ни странно, ЗОЖ, то есть здоровый образ жизни. Свежий воздух, физические упражнения. Без физических упражнений кишечник не сможет правильно работать, мышечная система будет дегенерировать.
Можно ли сказать, что вещества вроде никотина и алкоголя действуют на нас схожим образом? Ведь употребляя их, человек испытывает позитивные эмоции и стремится повторить этот опыт снова и снова.
Употребляя никотин, алкоголь, мы обычно через 30—50 минут получаем активацию работы нервной системы, связанную с выбросом позитивных гормонов. Мы это запоминаем и действительно стремимся повторить — причем во всех подробностях: одинаково зажигаем сигарету, нюхаем дым, создаем некий антураж и т. д. У многих сами эти ритуалы провоцируют выброс гормонов: химического эффекта еще нет, но мы уже получаем подкрепление в виде выделения гормонов и испытываем удовольствие.
Мы это запоминаем и действительно стремимся повторить — причем во всех подробностях: одинаково зажигаем сигарету, нюхаем дым, создаем некий антураж и т. д. У многих сами эти ритуалы провоцируют выброс гормонов: химического эффекта еще нет, но мы уже получаем подкрепление в виде выделения гормонов и испытываем удовольствие.
Относительно недавно выяснилось, что наш мозг производит собственный алкоголь, морфины и каннабиноиды. Эти вещества необходимы для многих биохимических реакций. Вырабатываемые организмом каннабиноиды, например, нужны, чтобы не было излишней активации нервной системы и мы не перевозбуждались. Дозы, которые выделяются естественным путем, микроскопические по сравнению с тем, что мы принимаем «снаружи». Когда мы искусственно в сотни раз повышаем эти дозы, то вмешиваемся в работу нервных сетей мозга. Если вмешательство оказывается постоянным, то оно сбивает нормальную работу сетей. Скажем, в норме каннабиноиды возвращают нас в спокойное состояние: мы можем реагировать, оценивать ситуацию, действовать. Переизбыток каннабиноидов выключает целые области нервной системы. Если мы принимаем подобные вещества в большом количестве или длительное время, то возникает зависимость и необходимость постоянно повышать дозы — а это уже патология, которую очень трудно преодолеть.
Если человек, находящийся в угнетенном состоянии, окажется в обществе жизнерадостных, энергичных людей, изменится ли его состояние в лучшую сторону? Иными словами, можно ли «заразиться» эмоциями от окружающих?
Заразиться эмоциями от других людей нельзя. Но если вы в такой компании будете сидеть и ничего не делать, то, скорее всего, на фоне активности окружающих у вас будет ухудшение состояния. Если же вы вынуждены что-то делать, вставать, петь песни, играть во что-то, плясать, танцевать, то ваши системы начнут приходить в норму. Если вы заставите себя хотя бы имитировать хорошее настроение, оно к вам придет. Это простая физиология — как коленный рефлекс или отдергивание на укол. Эмоциональные реакции — даже испуг — также облегчают выброс гормонов счастья.
Может ли просмотр комедий или смешных роликов инициировать выброс этих гормонов?
В гораздо меньшей степени, чем физическая вовлеченность. Но все же благодаря системе зеркальных нейронов мы в очень слабой форме будем воспроизводить то, что видим, — в том числе эмоции.
Можно ли приучить себя получать удовольствие от того, что тебе не нравится, но необходимо делать?
Естественно. Тут действует очень простой физиологический механизм. Когда вы заканчиваете что-то делать, вам становится хорошо. Вы получаете позитивные эмоции не от того, что что-то делаете, а от того, что наконец это доделали. Если вы думаете, что тренировки или соревнования приносят профессиональным спортсменам удовольствие, вы заблуждаетесь. Физические усилия — это очень тяжело. Люди испытывают удовольствие, когда тренировка заканчивается — и тем более, когда они побеждают. Но это уже социально-психологические, а не физиологические аспекты работы нервной системы.
Но это уже социально-психологические, а не физиологические аспекты работы нервной системы.
То есть нужно концентрироваться на результате?
Абсолютно точно. Тогда вы получите удовольствие даже от монотонной работы. Чтобы ускорить появление результата, можно разбивать работу на этапы. Еще один способ — вносить в свою деятельность элементы игры. Известно, что, играя, человек затрачивает в десятки раз больше энергии, чем выполняя работу земплекопа или лесоповальщика. Но он делает это с удовольствием. А копать не нравится никому. По-моему, Зигмунд Фрейд писал, что одна из базовых черт человека — нелюбовь к монотонному физическому труду.
Как усвоить новую, не свойственную нам привычку — скажем, заниматься спортом, вести здоровый образ жизни?
Если что-то вызывает у нас негативные эмоции, мы не хотим это повторять. Поэтому нужно связать свои действия с позитивом. Например, вы точно знаете, что вам с утра нужно пять раз отжаться, но очень не любите это делать.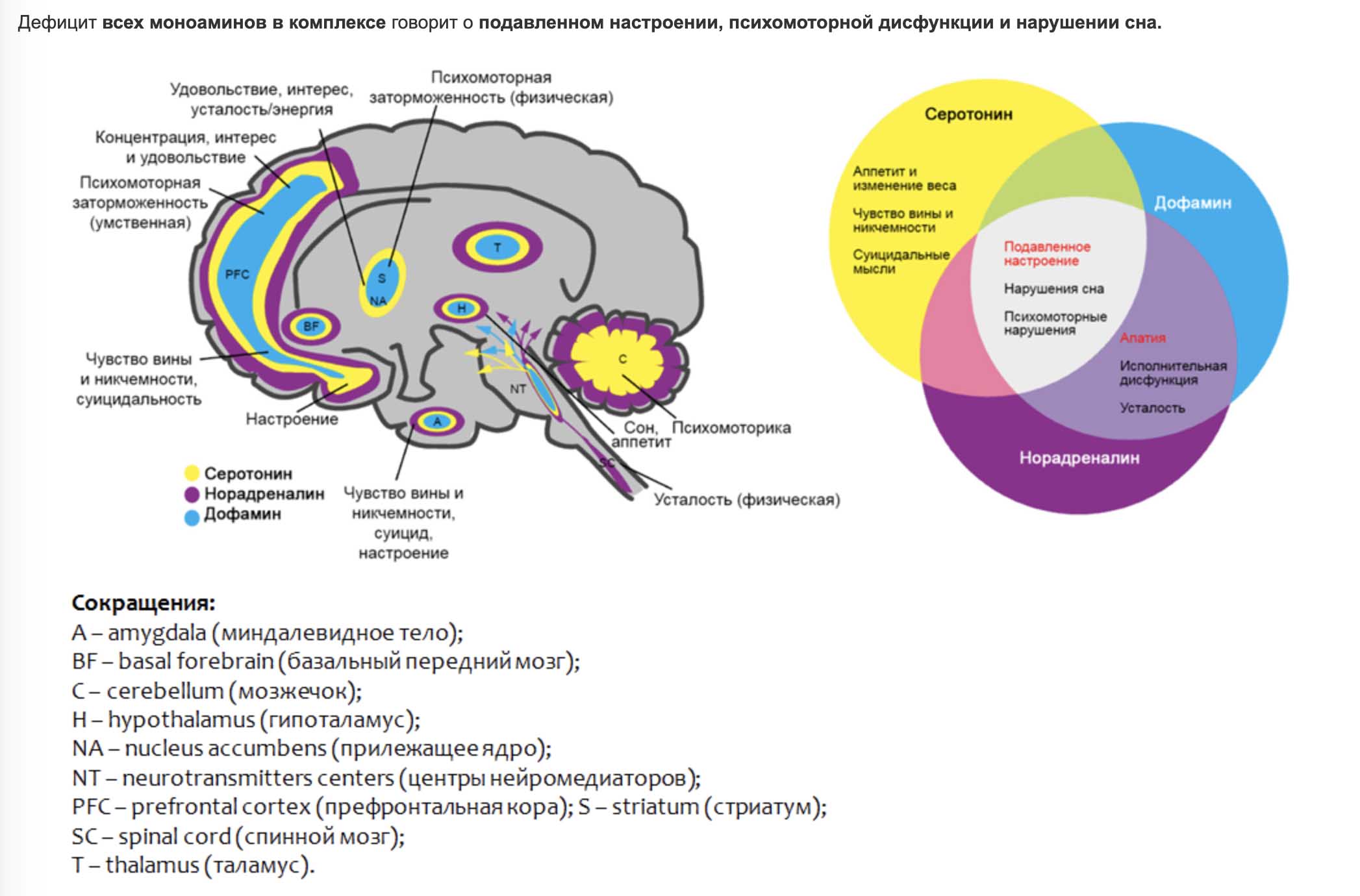 Тогда надо придумать для себя какую-нибудь награду — скажем, завтрак. Не отжались — остались без завтрака; отжались — позавтракали. Со временем организм будет требовать, чтобы вы перед завтраком пять раз отжались. В экспериментах Павлова в 1920-е годы были очень интересные наблюдения. Собаку обучали, что ее кормят по звуку колокольчика. Когда хорошо обученную голодную собаку приводили в лабораторию и давали ей еду, она не ела и жалобно смотрела на экспериментатора в ожидании звука колокольчика. Она не могла без этого есть, хотя до экспериментов колокольчик не имел к еде никакого отношения. Так работает нервная система.
Тогда надо придумать для себя какую-нибудь награду — скажем, завтрак. Не отжались — остались без завтрака; отжались — позавтракали. Со временем организм будет требовать, чтобы вы перед завтраком пять раз отжались. В экспериментах Павлова в 1920-е годы были очень интересные наблюдения. Собаку обучали, что ее кормят по звуку колокольчика. Когда хорошо обученную голодную собаку приводили в лабораторию и давали ей еду, она не ела и жалобно смотрела на экспериментатора в ожидании звука колокольчика. Она не могла без этого есть, хотя до экспериментов колокольчик не имел к еде никакого отношения. Так работает нервная система.
Беседовала Анна Натитник, старший редактор «Harvard Business Review Россия». Материал опубликован в номере за декабрь 2020 года под заголовком «Как мозг запускает реакции»
Адреналин, эндорфины и другие нейромедиаторы: что это и как работает
Наверное, вы слышали о «гормоне любви», «гормоне счастья» или «гормоне стресса»? Ученые ненавидят эти определения для нейромедиаторов, ведь все не так просто, и часто один нейромедиатор может вызвать противоположные эффекты. Рассказываем подробно, что такое нейромедиаторы, как они влияют на наши чувства и как мы можем повлиять на их баланс.
Рассказываем подробно, что такое нейромедиаторы, как они влияют на наши чувства и как мы можем повлиять на их баланс.
ЧТО ТАКОЕ НЕЙРОМЕДИАТОРЫ И КАК ЭТО РАБОТАЕТ
Нейроны общаются между собой с помощью химических веществ – так называемых нейромедиаторов. Благодаря этому нейронные сети в определенном участке мозга могут возбудиться, затормозить или начать лучше сотрудничать. Мы в свою очередь чувствуем это как радость, возбужденное ожидание результата, развитие планов или тревожность.
Когда один нейрон возбуждается, то в месте его соединения с другими нейронами или мышцами – синапсе – выделяются те же нейромедиаторы. Это сигнал, который следует принять и расшифровать. Способность к этому определяется наличием в клетке соответствующего рецептора. Рецептор и нейромедиатор взаимодействуют, как ключ и замок, или как элементы пазла, и это запускает сигнальный каскад – клетка «поняла», что ей сообщили. К рецепторам нейромедиаторов способны присоединяться и наркотические вещества, кофеин и алкоголь.
Затем нейромедиаторы разрушаются ферментами или поглощаются нейронами – это контролирует длительность сигнала. Именно на эти процессы действуют некоторые фармакологические препараты для лечения депрессии и предменструального дисфорического синдрома.
КАКИЕ БЫВАЮТ НЕЙРОМЕДИАТОРЫ И КАК ОНИ ВЛИЯЮТ
Адреналин
Известен также как эпинефрин, выделяется, когда нам страшно, мы злимся или очень возбуждены. Он усиливает внимание, расширяет зрачки, повышает уровень глюкозы в крови, заставляет жировую ткань расщеплять жиры, а также ускоряет сердцебиение, сужает сосуды внутренних органов, расширяет сосуды мышц и лица, дыхательные пути. Именно поэтому адреналин вводят при остановке сердца или анафилактическом шоке, а так называемые «взрывные тренировки» и борьба – так эффективны для похудения. Адреналин может действовать и как нейромедиатор, то есть от клетки к клетке, и как гормон, то есть вещество, которое распространяется кровотоком и имеет системное действие.
Норадреналин
Он же норэпинефрин. Это нейромедиатор, влияющий на внимание, реакцию «бей или беги» и интенсивность кровообращения. Нарушение образования и разрушения норадреналина сопровождают тревожность и бессонница (его много) или вялость и рассеянность (его мало). Людям с синдромом дефицита внимания (часто его называют детская гиперактивность) может не хватать именно норадреналина.
Дофамин
Он может отвечать за удовольствие, самопоощрение к определенной деятельности (например спорту, курению, потреблению кофе), ожидание счастья, ассоциативное обучение, стремление новизны, движение, принятия решений, адекватное восприятие действительности или желание определенных вещей, пищевое и сексуальное поведение. Дофамин выделяется от прослушивания любимой музыки. На дофамин разные люди могут реагировать по-разному: например, один из вариантов рецептора дофамина DRD4-7r кодирует так называемый «ген бродяги», ведь он связан с активной поисковой деятельностью, путешествиями и склонностью к наркотической зависимости и случайным связям.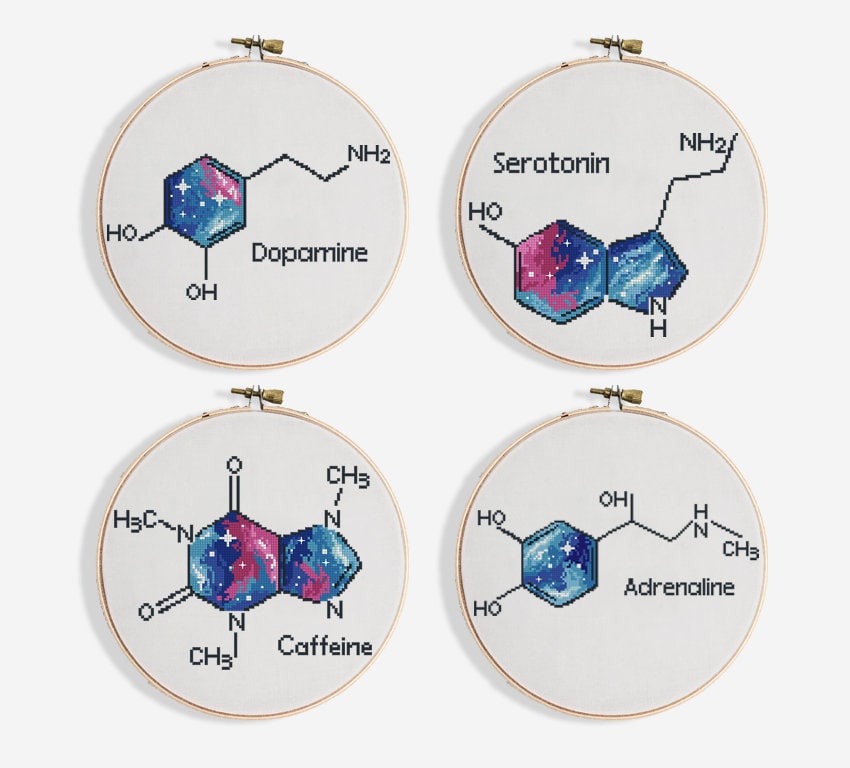 Или же некоторые люди должны получить очень сильный стимул, чтобы у них произошел выброс дофамина и они почувствовали удовольствие: таких людей много среди топ-менеджеров, азартных игроков и алкоголиков. Нарушение работы «дофаминовых прошивок» мозга происходит при болезни Паркинсона, синдроме дефицита внимания, зависимостях, в том числе от азартных игр, и шизофрении.
Или же некоторые люди должны получить очень сильный стимул, чтобы у них произошел выброс дофамина и они почувствовали удовольствие: таких людей много среди топ-менеджеров, азартных игроков и алкоголиков. Нарушение работы «дофаминовых прошивок» мозга происходит при болезни Паркинсона, синдроме дефицита внимания, зависимостях, в том числе от азартных игр, и шизофрении.
Серотонин
Дословно это слово переводится как «сыворотка бодрости». Он может действовать как гормон: его производят клетки кишечника, он распространяется кровотоком, к нему чувствительны ряд клеток – например, серотонин влияет на работу иммунной системы, заживление ран и свертываемости крови. Серотонин крови не попадает в мозг – этому препятствует гематоэнцефалический барьер. Недостаток серотонина связан с сезонным аффективным нарушением, депрессией и предменструальным синдромом. Если вы испытываете такие симптомы, как нарушение сна и пищевого поведения, нежелание выходить из дома, отсутствие радости от некогда любимых дел, плохое настроение, отсутствие сил, которые вы испытываете ежедневно по крайней мере две недели подряд, то следует обратиться к неврологу.
Гамма-аминомасляная кислота (ГАМК)
Это главный тормозной нейромедиатор мозга. Она гасит возбуждение нейронов, и когда ее много, мы нет, не приторможенные, а наоборот – сосредоточены и спокойны. У людей с расстройствами тревожности и посттравматическим синдромом меньший уровень ГАМК или рецепторов этого нейромедиатора. Образование ГАМК нарушено при эпилепсии и болезни Хантингтона. Кроме того, ГАМК участвует в контроле движений. ГАМК плохо преодолевает гематоэнцефалический барьер. Это означает, что даже если употреблять ее в таблетках, как предлагают производители БАДов, она не попадет в мозг. Зато есть обходной путь – потреблять достаточно витамина В6 и напитков, повышающих ее образование нейронами: чая (он содержит аминокислоту теанин), отвары или экстракты мелиссы, ромашки, хмеля, валерианы.
Ацетилхолин
Ацетилхолин – это главный нейромедиатор обучения, мышления и памяти. Если он действует на мышцы, то вызывает сокращение. Недостаток ацетилхолина проявляется как раздражительность, неспособность собраться с мыслями и мышечная слабость, а при болезни Альцгеймера гибель нейронов, выделяющих ацетилхолин, проявляется как провалы в памяти. Для образования ацетилхолина нужен витамин В1. Он в отрубях, говядине и свинине, стручковой фасоли и зеленом горошке, чечевице, кукурузе, орехах и семенах. Другой компонент образования ацетилхолина – это вещество холин. Содержится в печени, яйцах, цветной и брюсельский капусте, дорогих устрицах и доступных свекольных листьях. Есть из чего выбирать.
Если он действует на мышцы, то вызывает сокращение. Недостаток ацетилхолина проявляется как раздражительность, неспособность собраться с мыслями и мышечная слабость, а при болезни Альцгеймера гибель нейронов, выделяющих ацетилхолин, проявляется как провалы в памяти. Для образования ацетилхолина нужен витамин В1. Он в отрубях, говядине и свинине, стручковой фасоли и зеленом горошке, чечевице, кукурузе, орехах и семенах. Другой компонент образования ацетилхолина – это вещество холин. Содержится в печени, яйцах, цветной и брюсельский капусте, дорогих устрицах и доступных свекольных листьях. Есть из чего выбирать.
Глутамат
60–90% нейронов мозга общаются с помощью глутамата. Этот нейромедиатор отвечает за возбуждение в нервной системе, без глутамата невозможны обучение и запоминание. Кроме того, он вовлечен в развитие новых нервных связей – так называемую нейропластичность. Из глутамата образуется уже известная ГАМК. Глутамат нам знаком как пищевая добавка. Не волнуйтесь, что его много и он нейротоксичен – глутамат не попадает из крови в мозг.
Эндорфины
Это общее название для нейромедиаторов, вызывающих чувство удовольствия и обезболивания. Структурно они напоминают опиаты, отсюда и происходит название – «внутренние морфины». Соответственно, рецепторы эндорфинов называются опиатными. Эндорфины выделяются, когда мы делаем любимые дела, в том числе пьем кофе, занимаемся в тренажерном зале, во время секса и после употребления острой пищи, шоколада.
КАК ЗАБОТИТСЯ О БАЛАНСЕ НЕЙРОМЕДИАТОРОВ
- Не занимайтесь самолечением. Также не стоит систематически принимать транквилизаторы и так называемые ноотропы.
-
Питайтесь сбалансировано. Это единственная «универсальная таблетка». Витамины С, В1, В6, В12 и Е необходимы для образования нейромедиаторов и защиты нейронов от повреждения. Нет витаминов – нарушается образование серотонина, ацетилхолина и норадреналина.
 Рацион – это не только витамины, но и аминокислоты триптофан, тирозин и фенилаланин – предшественники нейромедиаторов. Наконец, здоровая микробиота кишечника обеспечивает усвоение витаминов и предшественников серотонина. Что есть, чтобы быть счастливыми? Прежде всего хумус, фалафель, мясо птицы, смородину, чернику, зеленый горошек и стручковую фасоль, все виды капусты, сладкий и острый перец, отрубной хлеб и овсянку, зеленый и белый чай, воду и не употреблять алкоголь. Если последний совет пока (!) не для вас, то выбирайте маленький бокал темного пива – это источник витаминов группы В и экстрактов хмеля.
Рацион – это не только витамины, но и аминокислоты триптофан, тирозин и фенилаланин – предшественники нейромедиаторов. Наконец, здоровая микробиота кишечника обеспечивает усвоение витаминов и предшественников серотонина. Что есть, чтобы быть счастливыми? Прежде всего хумус, фалафель, мясо птицы, смородину, чернику, зеленый горошек и стручковую фасоль, все виды капусты, сладкий и острый перец, отрубной хлеб и овсянку, зеленый и белый чай, воду и не употреблять алкоголь. Если последний совет пока (!) не для вас, то выбирайте маленький бокал темного пива – это источник витаминов группы В и экстрактов хмеля.
-
Будьте физически активными. Регулярные физические нагрузки и упражнения на баланс не дают нейронам умирать, помогают им взаимодействовать, вызывают выделение дофамина, серотонина, эндорфинов и эндоканабиноиды, стимулируют поглощение мозгом нужных аминокислот и настраивают тело на соблюдение советов по питанию и алкоголю. Ведь чтобы тренироваться, нужно придерживаться правильного рациона.

- Обнимайтесь. Окситоцин, который выделяется при объятиях или во время секса, увеличивает количество рецепторов ГАМК. Помните, при посттравматическом нарушении их становится мало. То есть окситоцин восстанавливает чувствительность мозга к ГАМК или прописанных врачом бензодиазепинам.
- Не игнорируйте тревожные сигналы. Если вы узнали симптомы депрессии, недостатка внимания, предменструального дисфорического нарушения, зависимости, посттравматического нарушения или тревожного расстройства, то немедленно поговорите об этом с близкими и обратитесь к врачу. Только врач может прописать вам нужный препарат и его дозу или посоветовать терапию.
Источник
Закрытые операции на мозге. Или управление гормонами при… | by Vanilla Thunder | DesignSpot
Или управление гормонами при проектировании взаимодействия.
Доброго вечерочка вам друзья. Мне очень приятно что вы решили прочесть эту статейку, потратив немного вашего бесценного времени, и я спешу сказать вам спасибо.
И у меня к вам сразу вопрос: как вы выбирали, что надеть сегодня утром? Вы можете сказать, что надели то, что вам нравится. Но почему вам нравится то, что нравится? Знаете-ли вы, что наш мозг, как кукловод дёргает за ниточки, подталкивая к краю нужного ему решения? Думаете, что у вас и вашего мозга всегда одинаковые желания? Хм… В идеальном мире — да, но эволюция внесла в эту схему свои коррективы. Например, мне хочется быть стройным, подтянутым и здоровым, и при этом, выработанная веками тяга к большому количеству жиров и соли, не даёт мне это сделать. Но сегодня мы не будем говорить о том, как преодолеть вредные привычки, а скорее о том, как самому поиграть в этого самого кукловода.
И пред тем, как начать, думаю, не лишним будет присмотреться к тому, как и на чём работает наш мозг. Если не вдаваться в детали, то в основе работы нашего самого дорогого органа лежат интересные вещества — гормоны. Их повышение или понижение в определённых зонах нашего мозга заставляет нас чувствовать, запоминать и вспоминать, думать.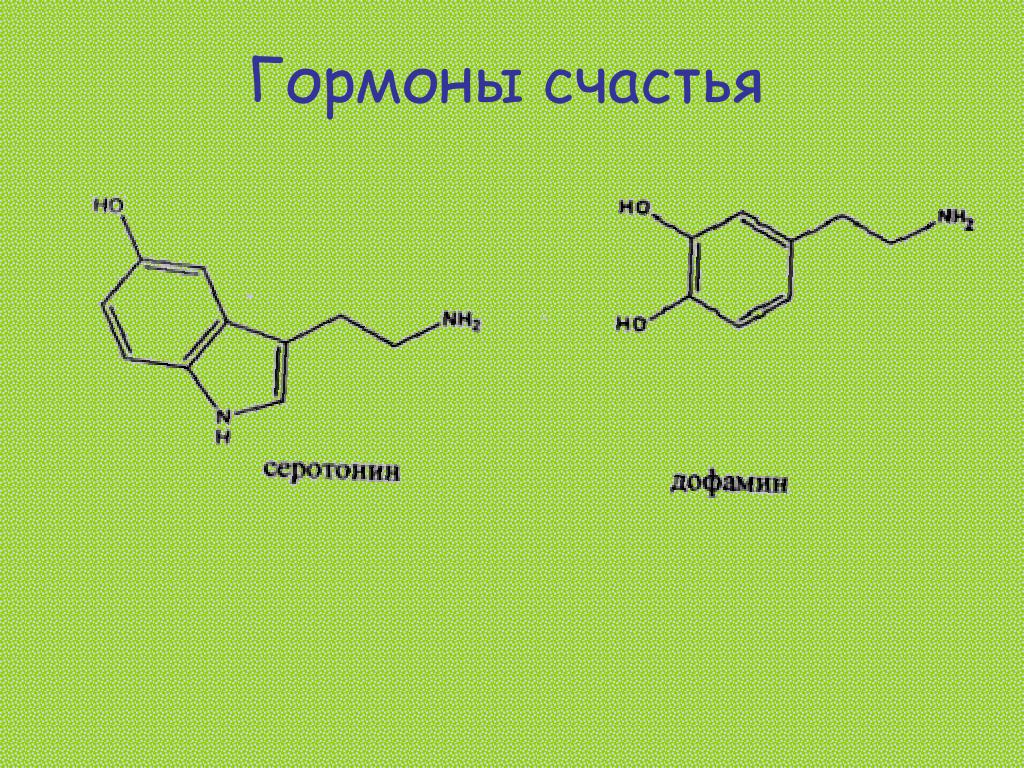 Например, стоит нам наполнить базальные ганглии кортизолом, как начинаем испытывать тревогу, или если дофамин не отпустит нашу поясную извилину, то мы не сможем переключиться на другое дело (так кстати и возникают обсессивно-компульсивные расстройства).
Например, стоит нам наполнить базальные ганглии кортизолом, как начинаем испытывать тревогу, или если дофамин не отпустит нашу поясную извилину, то мы не сможем переключиться на другое дело (так кстати и возникают обсессивно-компульсивные расстройства).
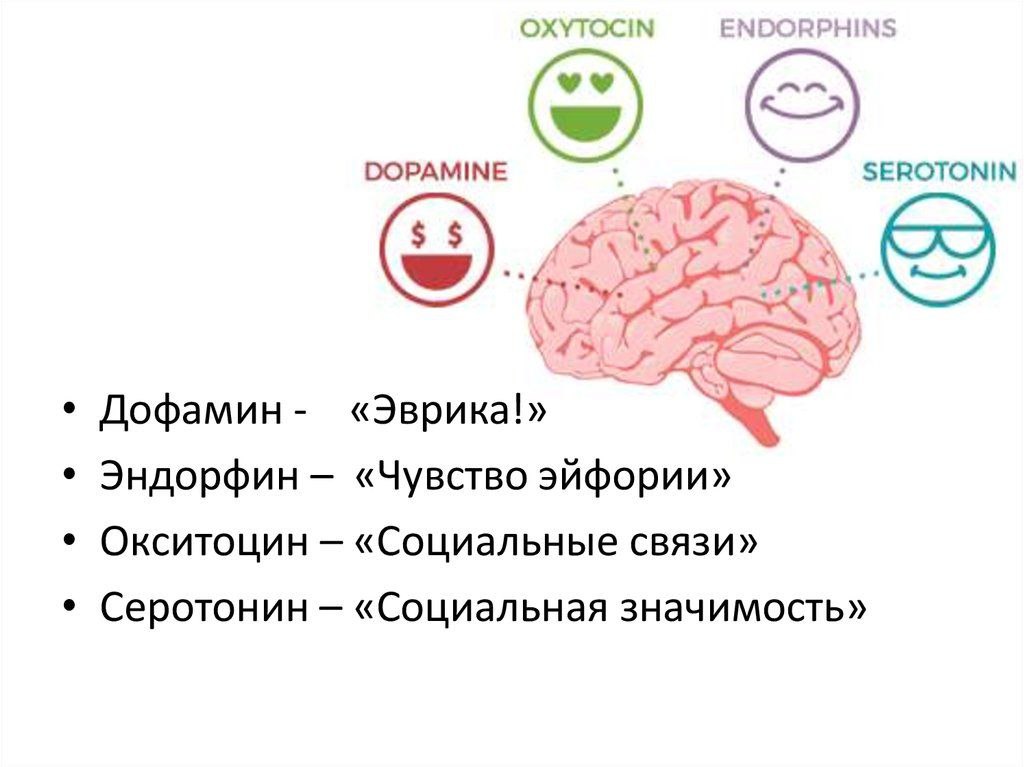
Гормонов у нас довольно много, около 60, но сосредоточимся мы сегодня всего на 4 самых интересных: дофамин, серотонин, окситоцин и эндорфин. Почему именно эта четвёрка? Потому, дорогие мои, что это счастье в чистом виде. Повышение уровня именно этих гормонов дарит нам ощущения умиротворения, радости и вдохновения. А кто не хочет быть счастливым?
Такие гормоны вырабатываются гипофизом и гипоталамусом, которые в свою очередь объединяются лимбической системой — специальной зоной нашего мозга, отвечающей за эмоции и память.
Но зачем нам знать обо всех этих гормонах или нейромедиаторах, ведь работающие практики проектирования можно применять и без этого? Это так, знание основ работы мозга само по себе ничего не изменит — мозг не станет работать иначе от того, что вы поймёте, как происходит мыслительный процесс. Но всё-таки гораздо проще жить, когда глаза открыты, чем блуждать вслепую. Благодаря этому знанию, вы сможете понять «как» и по-новому взглянуть на уже устоявшиеся методики, а может даже и придумать новые, более эффективные способы проектирования взаимодействия, помочь людям обрести новые привычки.
Но всё-таки гораздо проще жить, когда глаза открыты, чем блуждать вслепую. Благодаря этому знанию, вы сможете понять «как» и по-новому взглянуть на уже устоявшиеся методики, а может даже и придумать новые, более эффективные способы проектирования взаимодействия, помочь людям обрести новые привычки.
Важно знать: что способствует выработке гормонов счастья или избавляет нас от стресса — является нашей привычкой.
И немного о том, как привычки формируются. В нашем мозге существует два вида вещества: серое и белое. По сути и то и то — нейроны, однако белые отличаться от серых изолирующей миелиновой оболочкой. Ею мозг защищает самые важные и быстрые связи от разрушения. Миелин активно вырабатывается в раннем возрасте и со временем ослабевает, потому учиться и прокладывать новые нейронные магистрали взрослым людям становится сложнее.
Процесс формирования нейронных связей напоминает Хадукен из игры Street Fighter, когда в синапсе (соединении) происходит прорыв импульса от одного нейрона к другому.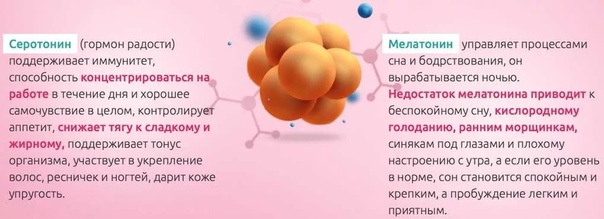 Но чтобы эту связь закрепить можно или многократно ее активировать или связать ее с сильными эмоциями. Первое долго но качественно, втрое быстро но стихийно. Здесь-то и вступают в игру нейромедиаторы, так как они и ответственны за эмоции. То есть моделируя поведение с выработкой этих гормонов, мы можем закрепить в памяти людей нужные нам паттерны.
Но чтобы эту связь закрепить можно или многократно ее активировать или связать ее с сильными эмоциями. Первое долго но качественно, втрое быстро но стихийно. Здесь-то и вступают в игру нейромедиаторы, так как они и ответственны за эмоции. То есть моделируя поведение с выработкой этих гормонов, мы можем закрепить в памяти людей нужные нам паттерны.
Как вообще эти гормоны появились? У каждого из них своя функция, но причина возникновения одна и та же — обеспечить наше выживание. Можно сказать, что появились они в процессе эволюции, что объясняет, почему их выделение так приятно: так природа закрепляет паттерны, благоприятствующие нашему выживанию. Эта концепция и объясняет, почему нам нужно учитывать это при проектировании взаимодействия.
Делайте пользователя счастливее и закрепляйте нужные вам привычки и паттерны.
Это основная мысль всей статьи, которую заклинаю вас запомнить. Теперь же давайте посмотрим, как можно добиться этого приятного эффекта.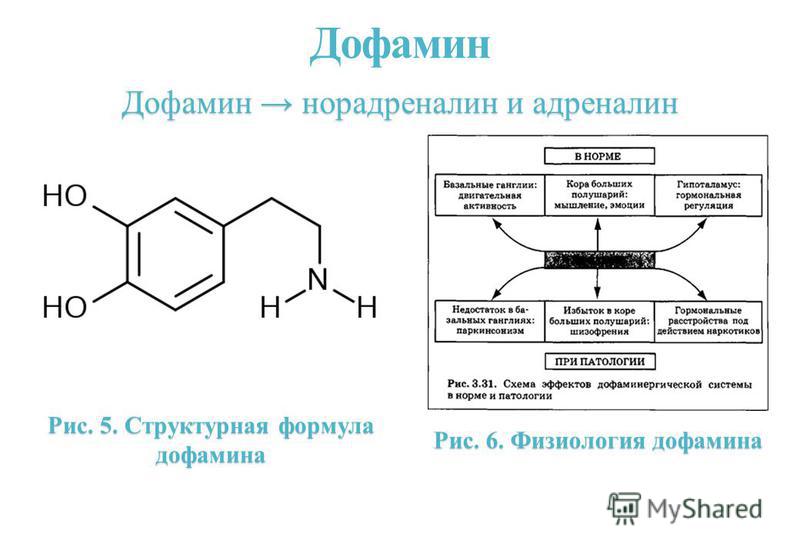 Как я и сказал ранее, хоть дофамин, окситоцин, серотонин и эндорфин формируют нашу радость, все же они немного отличаются. То есть работать с ними нужно по-разному. И давайте начнём с местной рок-звезды — дофамина.
Как я и сказал ранее, хоть дофамин, окситоцин, серотонин и эндорфин формируют нашу радость, все же они немного отличаются. То есть работать с ними нужно по-разному. И давайте начнём с местной рок-звезды — дофамина.
найди меня если сможешь
Сперва, давайте познакомимся, вот как выглядит этот негодник.
Ну, такое. Если вы не Уолтер Уайт или хотя бы не увлекаетесь химией, то эта форма для вас, наверное, как и для меня — прикольный гексагон с палочками. Но погодите, все станет интереснее.
Дофамин принято считать главарём нашей шайки гормонов, ибо о нём в нашем UX мире твердят почти на каждом углу. На самом же деле, у дофамина хороший пиар-менеджер, и окситоцин, серотонин, эндорфин ничуть ему не уступают. Думаю, что с ним нам просто проще работать.
Дофамин был придуман природой для для стимулирования в нас поиска новой информации. Когда мы видим что-то новое, когда мы учимся и движемся к цели путем экспериментов, наш мозг наполняет этот нейромедиатор, вызывая приливы радостного волнения — вдохновения. Не можете припомнить такого? А я напомню.
Не можете припомнить такого? А я напомню.
Вы достаточно стары, чтобы помнить киндеры с бегемотиками? Помните то волнение, когда, вам давали этот волнующий презент, вы снимали с него эту фольгу, которая влипала в шоколад и психуая, вы просто разрывали это поганое яйцо лишь бы добраться до жёлтого пластикового контейнера, в котором томилась эта желанная награда… и опять повторка.
В общем, Kinder Surprise хоть и запрещены в Евросоюзе, но могут дать вам ценный совет: если хотите грамотно работать с дофамином, просто следуйте схеме: стимул — вовлечение — действие — вознаграждение — стимул… Так, работает любого рода игрофикация. С помощью коллекций, лутбоксов, дропа или что-там нынче модно, мы вовлекаемся в дофаминовые петли разной ширины. Как например здесь это делает Duolingo:
Но это прямая работа с дофамином, нас же интересуют более тонкие материи. Как я и сказал, дофамин отвечает за интерес, обучение и исследование. Значит, стоит поощрять пользователя за самостоятельное изучение сервиса. В книге «Эмоциональный дизайн» приводился один интересный пример, как (вроде бы) Mint.com устроили на своём портале настоящую охоту за пасхальными яйцами, разбросав по разным страничками сайта яички, каждое из которых стоило денег. Не стоит и говорить, что все они были найдены в течение нескольких часов, но ажиотаж продолжался несколько месяцев. С тех пор эту тактику вовлечения используют все: google, kickstarter, youtube, coca-cola и многие многие другие.
В книге «Эмоциональный дизайн» приводился один интересный пример, как (вроде бы) Mint.com устроили на своём портале настоящую охоту за пасхальными яйцами, разбросав по разным страничками сайта яички, каждое из которых стоило денег. Не стоит и говорить, что все они были найдены в течение нескольких часов, но ажиотаж продолжался несколько месяцев. С тех пор эту тактику вовлечения используют все: google, kickstarter, youtube, coca-cola и многие многие другие.
Подогревать интерес можно и случайными действиями или подарками (они работают лучше), но можно использовать и эффект Зейгарник или открытый гештальт. Эффект Зейгарник гласит, что незаконченный мем информации запоминается лучше, чем… Таким образом, начав за пользователя действие, мы повысим его уровень дофамина, а также увеличим его вовлечённость в процесс.
Так, например, предоставляя пользователю промокод на какой-то вид товаров мы подталкиваем его к изучению нужного нам раздела. А дальше воображение и желание этот гештальт закрыть сделают всю черную работу.
Но порой даже не нужно тратить средства на столь масштабные изменения, достаточно прибегнуть к маленьким доставляющим мелочам. Так в свое время меня покорила Asana всего одной своей фичей — иногда, по закрытию задачи, случайным образом мог возникнуть единорог и пролететь пол экрана. И все. Весь мозг заполнен дофамином от столь неожиданного сюрприза и желания разгадать коварный алгоритм появления рогатой лошади. Эта фича практически ничего не стоила, но выхлоп колоссальный: я не просто начал работать в приложении, но ещё и делить работу на более мелкие задачи, ведь так вероятность появления единорожки была выше. А вместе с тем поднялась и моя продуктивность.
Однако помимо всех дофаминовых радостей, есть и оборотная сторона медали — привыкание. Самый первый кусочек мороженого самый вкусный, а дальше мозг не получая новой информации прекращает выработку дофамина и нам становится уже не так радостно. Наш мозг — скупердяй, и не может разбазаривать столь ценные вещества попусту.
Если перекладывать этот факт на интерфейс, то дофаминить пользователя нужно каждый раз чем-то новым.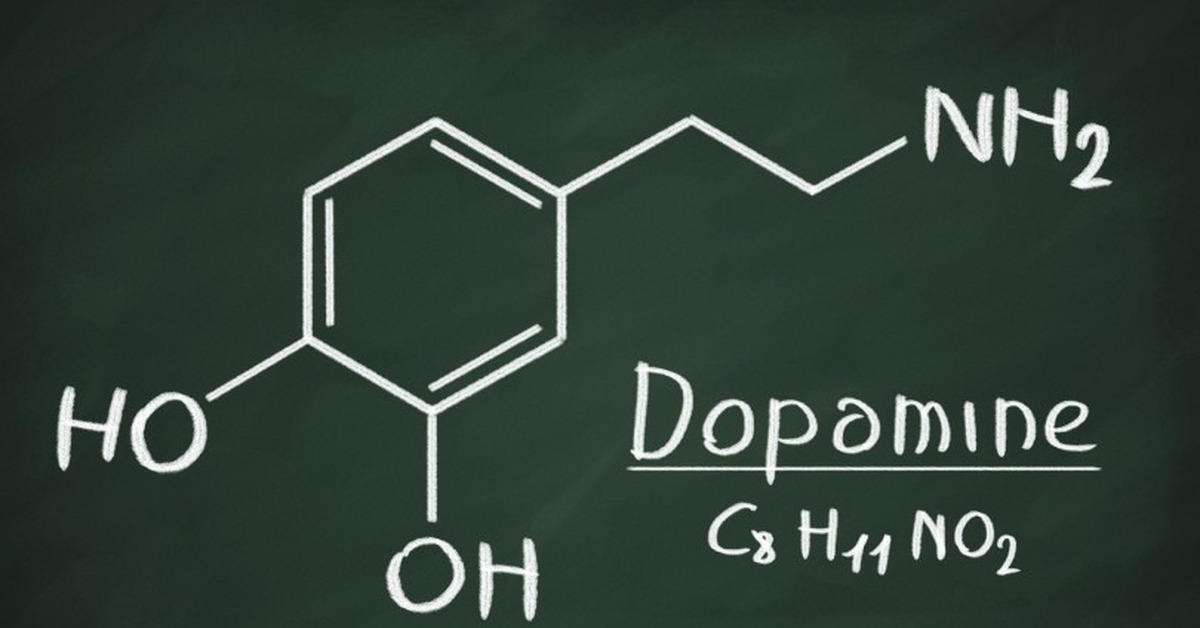 Покажите, как ваш сервис меняется, что на нём появляется нового, а если ничего, то как можно по-новому использовать старое.
Покажите, как ваш сервис меняется, что на нём появляется нового, а если ничего, то как можно по-новому использовать старое.
Вот один антипример — UXpressia. Если кто-то когда-то пользовался этим сервисом, то помнит, что он был более-менее хорош, и я был очень воодушевлён, когда обнаружил его. Моё портфолио пестрило множеством артефактов оттуда. Но в один прекрасный момент, я просто перестал им пользоваться. Потому, что я не видел в нём развития. Может ребята делали много полезного, но не говорили об этом, потому показалось, что проект стагнирует. Я вырвался их дофаминовой петли и наткнулся на отходняк.
Другой пример Miro, бывший Realtimeboard. Они постоянно говорят о новых функциях и улучшениях, тем самым создавая ореол постоянного развития и по капельке поддерживая уровень дофаминового вовлечения. Таким образом у нас плотно скрепляется образ Miro и инноваций, приправляя все радостью.
Аналогично поступают и в airtable. Только вместо того, чтобы говорить о новшествах, они рассказывают о том, как их продукт используют в разных контекстах, подталкивая наш мозг к экспериментам и дофаминовому трипу.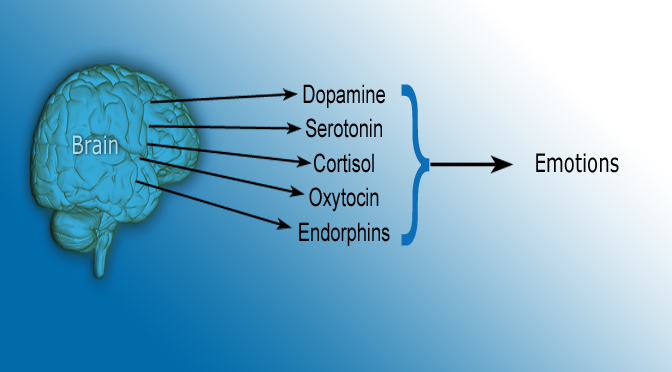
Нейробиолог СПбГУ рассказал о пяти способах сохранить хорошее настроение во время самоизоляции
«Традиционно выделяют два основных нейромедиатора, которые тесно связаны с настроением, — это дофамин и серотонин, — объясняет Рауль Гайнетдинов. — Если говорить упрощенно, дофамин — это нейромедиатор удовольствия и наслаждения, а серотонин — эмоционального равновесия. Некоторые называют последний «гормоном счастья», но это не совсем так. Оба нейромедиатора хорошо и давно изучены и являются основными мишенями для множества психостимуляторов, антидепрессантов и противотревожных средств».
Триптофановая диета
«Сегодня ученым известно, что концентрацию дофамина нельзя изменить с помощью диеты, а вот серотонина — можно, — продолжает профессор. — Ключевые ферменты для синтеза этих нейромедиаторов очень похожи. Отличие заключается в том, что для дофамина он полностью насыщен, а для серотонина — наполовину, значит, можно повышать в крови концентрацию предшественника серотонина, триптофана, и получать увеличение этого нейромедиатора.
Солнечный свет
«Некоторые исследования показывают, что концентрация серотонина зависит от того, сколько человек получает солнечного света, — говорит нейробиолог. — Потому что процесс его синтеза частично регулируется витамином D, который вырабатывается в организме как раз под воздействием солнца. Есть такое понятие — сезонная депрессия, которой весной или осенью бывают подвержены жители северных регионов, например Финляндии или Санкт-Петербурга. Нередко они связаны именно с недостатком солнечного света». Словом, даже если выходить из квартиры не удается, в солнечную погоду стоит почаще бывать на балконе и открывать окна.
Насыщение кислородом
«Логично предположить, что, если человек долго не выходит из дома и не получает достаточное количество кислорода, у него может возникнуть дисбаланс нейромедиаторов, — объясняет ученый. — Потому что этот жизненно важный газ тоже участвует в синтезе серотонина. С помощью метода гипербарической оксигенации, когда кровь пациента в специальной барокамере насыщают кислородом, сегодня даже пытаются лечить депрессии. Ну и известный факт, что во время выполнения упражнений в кровь тоже попадает большое количество кислорода. Кстати, физическая нагрузка способствует нейрогенезу — восстановлению нервных клеток».
Запах хвои
Хотя ароматерапия и не считается авторитетной наукой, все же некоторые ее достижения, как показывают исследования, способны заметно улучить настроение человека. «Сегодня мы занимаемся изучением «двоюродных братьев» серотонина и дофамина — следовых аминов и рецепторов к ним, в частности TAAR5, и смогли доказать, что эти рецепторы представлены не только в обонятельной системе, но и в отделах мозга, ответственных за эмоции, — рассказывает Рауль Гайнетдинов. — Что интересно, TAAR5 отвечает за восприятие инстинктивных самых неприятных для человека запахов, которые вызывают негативные эмоции. Однако выяснилось, что блокатором для этих рецепторов является вещество тимберол, которое имеет запах смолы хвойных деревьев. Вот почему я не удивлен попыткам лечения депрессии и тревожности с помощью ароматерапии, включающей запах сосновых деревьев».
— Что интересно, TAAR5 отвечает за восприятие инстинктивных самых неприятных для человека запахов, которые вызывают негативные эмоции. Однако выяснилось, что блокатором для этих рецепторов является вещество тимберол, которое имеет запах смолы хвойных деревьев. Вот почему я не удивлен попыткам лечения депрессии и тревожности с помощью ароматерапии, включающей запах сосновых деревьев».
Дофаминовое голодание
Сегодня получила известность необычная практика из Кремниевой долины под названием «дофаминовое голодание». Люди, пресыщенные удовольствиями, стараются на время ограничить себя во вкусной еде, гаджетах, компьютерных играх, сериалах, общении и алкоголе, чтобы, как они считают, временно избежать пика выброса дофамина и дать дофаминовым рецепторам снова стать более чувствительными. «Изоляция, в которой мы все сегодня оказались, в какой-то степени тоже «дофаминовое голодание», — говорит нейробиолог. — Практика воздержания от удовольствий в виде поста знакома многим религиям, если подходить очень упрощенно, то это такая «переустановка дофаминового нуля». В целом данная теория является более-менее правдоподобной, но, конечно же, не все так просто: кроме дофамина важную роль в эмоциональном состоянии играют серотонин, норадреналин, эндорфины и многие другие нейромедиаторы, и взаимодействие между ними очень сложное. Все же думаю, что, когда мы снова сможем пойти в любимое кафе или встретиться с близком другом, радость от этих событий на фоне «дофаминового голодания» во время самоизоляции будет намного ярче и мы заново научимся ценить те маленькие радости, которые не замечали раньше».
Серотонин против. Дофамин: основные сходства и различия
- Серотонин помогает вам чувствовать себя счастливее, спокойнее и сосредоточеннее, в то время как дофамин заставляет вас чувствовать себя мотивированными, успешными и продуктивными.
- Серотонин и дофамин играют роль в регулировании нашего пищеварения, подавляя или увеличивая аппетит в соответствии с потребностями нашего организма.

- Недостаток серотонина, дофамина или обоих нейромедиаторов был связан с определенными психическими расстройствами, такими как зависимость и депрессия.
- Эта статья была рецензирована с медицинской точки зрения Дэвидом А. Меррилом, доктором медицины, психиатром и директором Тихоокеанского центра здоровья мозга Тихоокеанского института неврологии в Центре здоровья Провиденс Сент-Джонс в Санта-Монике, Калифорния.
- Посетите справочную библиотеку Insider Health Reference, чтобы получить дополнительные советы.
Дофамин и серотонин являются нейротрансмиттерами — химическими посредниками, которые передают сигналы между клетками, — которые регулируют такие функции организма, как настроение, сон и пищеварение.
Хотя дофамин и серотонин оказывают схожее действие на организм, они действуют немного по-разному. Вот что вам нужно знать о сходствах и различиях между дофамином и серотонином.
Дофамин мотивирует вас
Дофамин накапливается в головном мозге и попадает в кровоток, когда вы испытываете приятные ощущения, например, слушаете музыку или едите то, что вам нравится.
Нейромедиатор играет важную роль в системе мотивации и вознаграждения вашего тела, стимулируя позитивное настроение, чувство продуктивности и повышая мотивацию.Вы, вероятно, почувствовали действие дофамина после выполнения сложной задачи или достижения цели.
«Хотя дофамин не вызывает приятных переживаний, он действительно служит для усиления приятных переживаний», — говорит Кристин М. Стовер, психолог, лицензированный психолог из Флориды и США. телездравоохранение специалист в AristaMD, провайдере телемедицины.
Связанные Как повысить уровень дофамина и почувствовать себя лучшеНапример, если вы случайно купили лотерейный билет, вы не почувствуете немедленного вознаграждения.Однако, если вы в конечном итоге выиграете, вы, вероятно, испытаете прилив дофамина, что повысит вероятность того, что вы снова купите лотерейный билет, чтобы испытать те же острые ощущения.
Поскольку дофамин связан с системой вознаграждения и усиливает приятные переживания, считается, что он играет роль в зависимости и компульсивных азартных играх, хотя исследователи еще не уверены в точной связи между дофамином и этим поведением.
Допамин также влияет на память, познание, сон, внимание и способность к обучению.Недостаточный уровень дофамина может быть связан с депрессией или болезнью Паркинсона.
Серотонин помогает вам чувствовать себя хорошо
Серотонин играет роль в том, как мы обрабатываем наши эмоции, что может повлиять на то, как мы себя чувствуем. Серотонин попадает в кровоток после физических упражнений или пребывания на солнечном свете. Правильный уровень серотонина может сделать вас более счастливым, спокойным, сосредоточенным и менее тревожным.
Связанные 5 проверенных способов естественного повышения уровня серотонинаМежду тем, низкий уровень серотонина может иметь противоположный эффект и негативно влиять на ваше настроение.По словам Стовер, низкий уровень серотонина связан с депрессией, а также с нарушениями сна и аппетита.
Серотонин также регулирует важные функции организма. Например, ваш кишечник, в котором содержится 90% общего серотонина в организме, выделяет химические вещества, когда вы едите, чтобы стимулировать работу кишечника и перемещать пищу через пищеварительную систему. Тромбоциты крови также выделяют серотонин, когда вы получаете порез или царапину для заживления ран.
Другие функции организма и процессы, которые помогает регулировать серотонин, включают:
- Настроение
- Эмоции
- Ваш циркадный ритм или цикл бодрствования и сна
- Аппетит
- Метаболизм
- Концентрация
- 21 Гормоны
- Кофе и гормоны. Вот как кофе действительно влияет на ваше здоровье. (нет данных) Precision Nutrition . Получено с https://www.precisionnutrition.com / кофе и гормоны
- Вам нужен рецепт от природы? (2013, 19 июня). Получено с http://www.webmd.com/balance/features/nature-therapy-ecotherapy .
- Эфирные масла: Ядовиты при неправильном использовании. (2014). Национальный центр по борьбе с отравлениями. Получено с https://www.poison.org/articles/2014-jun/essential-oils
- Как повысить уровень серотонина и дофамина? (2017, 14 августа). Фонд ЛИВЕСТРОНГ. Получено с http: //www.livestrong.ru / article / 301434-как-я-повысить-уровни-серотонин-дофамин /
- Jenkins, T.A., Nguyen, J.C.D., Polglaze, K.E., & Bertrand, P.P. (2016, 20 января). Nutrients, 8 (1), 56. Получено с http://www.mdpi.com/2072-6643/8/1/56/htm
- Lv, X.N., Liu, Z.J., Zhang H.J., & Tzeng C.M. (2014). Ароматерапия и центральная нервная система (ЦНС): терапевтический механизм и связанные с ним гены. Текущие цели в отношении лекарств , 8 (14), 872-879. Получено с http: // www.ncbi.nlm.nih.gov/pubmed/23531112#
- Новинка и мозг: почему новые вещи заставляют нас чувствовать себя так хорошо. (2013, 21 мая). Получено с https://lifehacker.com/novelty-and-the-brain-why-new-things-make-us-feel-so-g-508983802 .
- Омега-3 жирные кислоты и расстройства настроения. (2012). Today’s Dietitian , 14 (1), 22. Получено с http://www.todaysdietitian.com/newarchives/011012p22.shtml
- Благодарность связана с позитивными изменениями в мозгу и теле. (2011, 23 ноября). ABC News. Получено с http://abcnews.go.com/Health/science-thankfulness/story?id=15008148
- Вот как ваш мозг становится зависимым от кофеина. (2013, 9 августа). Получено с https://www.smithsonianmag.com/science-nature/this-is-how-your-brain-becomes-addicted-to-caffeine-26861037/ .
- Почему наш мозг любит краткосрочные цели. (2013, 3 января). Получено с https://www.entrepreneur.com/article/225356 .
- Янг, С. (2007). Как повысить уровень серотонина в мозге человека без лекарств. Журнал психиатрии и неврологии, 32 (6), 394-399. Получено с http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2077351/ .
-
Автор: П.H., E.C.D. и R.M.W. спланированное исследование; P.H., E.C.D., R.L., K.M.W. и P.T. проведенное исследование; P.H. и E.C.D. проанализированные данные; и P.H., E.C.D., R.L., K.M.W. и R.M.W. написал газету.
-
Авторы заявляют об отсутствии конфликта интересов.
-
Эта статья представляет собой прямое представление PNAS.
-
Эта статья содержит вспомогательную информацию на сайте www.pnas.org/lookup/suppl/doi:10.1073/pnas.1201547109/-/DCSupplemental.
- www.globaldrugsurvey.com
- Заметное повышение температуры тела (гипертермия)
- Обезвоживание
- Нарушение баланса электролитов (натрия)
- Высокое артериальное давление (гипертония)
- Непроизвольное сжимание челюсти и скрежетание зубами
- Жесткость мышц или суставов
- Отсутствие аппетита
- Нелогичные или дезорганизованные мысли
- Беспокойные ноги
- Тошнота
- Приливы или озноб
- Головная боль
- потеет
- Обморок
- Панические атаки
- Потеря сознания
- Изъятия
- Почечная недостаточность
- Отек головного мозга
- Арритмия (нерегулярное сердцебиение) и повреждение сердца
- Раздражительность
- Депрессия
- Импульсивность
- Нарушение внимания и памяти
- Беспокойство
- Напор
- Нарушения сна
- Трудности концентрации
- Отсутствие аппетита
- Болезнь сердца
- Снижение когнитивной функции
Взаимосвязь между серотонином и дофамином
Серотонин и дофамин не действуют независимо друг от друга.Вместо этого они работают вместе, чтобы создать сложные модели поведения.
«Когда изменяется один нейромедиатор, изменяется функция или преобладание другого вещества», — говорит Стовер. «Повышенный уровень серотонина может привести к снижению активности дофамина и наоборот».
Например, серотонин подавляет импульсивное поведение, а дофамин усиливает его. Поскольку низкий уровень серотонина может вызвать перепроизводство дофамина, некоторые исследователи говорят, что это может привести к усилению импульсивного поведения.
Допамин и серотонин также оказывают противоположное влияние на аппетит. Низкий уровень дофамина стимулирует чувство голода, а низкий уровень серотонина подавляет чувство голода. Следовательно, правильные уровни обоих нейротрансмиттеров важны для адекватного получения сигналов голода и распознавания, когда вы наелись.
Серотонин, дофамин и депрессия
Поскольку и дофамин, и серотонин влияют на настроение, считается, что они играют роль в расстройствах настроения, таких как депрессия.Например, исследователи наблюдали снижение уровня серотонина у людей с депрессией и другими психическими заболеваниями, такими как тревожность и синдром дефицита внимания с гиперактивностью (СДВГ).
Связанные Как распознать признаки депрессии и эффективно справиться с симптомами
Однако это не означает, что низкий уровень серотонина вызывает депрессию, говорит Стовер.Депрессия — это сложное расстройство, вызванное сочетанием множества различных факторов, включая семейный анамнез, стрессовые жизненные события и травмы. Таким образом, низкий уровень серотонина может быть частью общей картины, но, вероятно, не может полностью объяснить, почему возникает депрессия.
«Поскольку серотонин отвечает за сон, настроение и пищеварение, мы часто видим симптомы депрессии, которые отражают этот дисбаланс, например, слишком много или слишком мало сна, отсутствие аппетита или переедание», — говорит Стовер.
Хотя низкий уровень серотонина сам по себе не является прямой причиной депрессии, лекарства, нацеленные на это химическое вещество, могут улучшить симптомы депрессии.Например, селективные ингибиторы обратного захвата серотонина (СИОЗС), распространенный тип антидепрессантов, увеличивают содержание серотонина в головном мозге. Это улучшает связь между клетками мозга и может помочь поднять вам настроение.
Низкий уровень дофамина также может вызывать некоторые симптомы депрессии, такие как отсутствие мотивации и потеря удовольствия от занятий, которые вам когда-то нравились.
Длительный или хронический стресс также может привести к повышению уровня кортизола — гормона, выделяемого в результате стрессовой реакции. Высокий уровень кортизола снижает выработку как серотонина, так и дофамина и связан с депрессией, говорит Николь Авена, доктор философии, доцент нейробиологии в Медицинской школе Маунт-Синай и приглашенный профессор психологии здоровья в Принстонском университете.
«Нацеливание на дофаминовую систему — один из способов, с помощью которых мы можем изучить потенциальные механизмы и методы лечения депрессивного поведения», — говорит Авена.
Insider’s takeaway
Дофамин и серотонин являются нейромедиаторами, которые участвуют во многих схожих функциях организма, хотя у них есть ключевые различия в том, как они влияют на поведение. В целом, дофамин и серотонин работают вместе, чтобы помочь регулировать настроение, а низкий или повышенный уровень любого из гормонов может негативно повлиять на ваше психическое здоровье.
Блог Терапия, Терапия, Блог Терапии, Терапия с блогами, Терапия, ..
Нейротрансмиттеры — это химические посредники, передающие электрические сигналы между нейронами мозга. Дофамин и серотонин — два важных нейромедиатора для психического здоровья. Они влияют на ваше настроение, память, сон, либидо, аппетит и многое другое. Дисбаланс может способствовать развитию зависимости, нарушениям настроения, проблемам с памятью и проблемам с вниманием.
За последние несколько десятилетий в мире увеличилось количество лекарств от дисбаланса серотонина и дофамина.Эти рецепты могут помочь в лечении симптомов многих психических заболеваний. Тем не менее, у них есть длинный список потенциальных побочных эффектов, от головокружения до бессонницы. Кроме того, их эффективность варьируется от человека к человеку.
Некоторые люди хотят попробовать немедикаментозные методы лечения, прежде чем принимать лекарства. Другие принимают лекарства, но хотят дополнить их другими стратегиями. Ниже приведены 10 способов повысить уровень дофамина и серотонина, которые не требуют приема таблеток:
1. Упражнение
Регулярные упражнения по крайней мере 30 минут каждый день улучшают общее настроение.Исследования показали, что длительные сердечно-сосудистые упражнения повышают уровень серотонина в головном мозге. Серотонин может снизить враждебность и симптомы депрессии. Это также способствует доброжелательности.
( Подробнее: Move для вашего настроения: сила упражнений для снятия депрессии)
2. Проведите время на природе
В предыдущих поколениях люди проводили большую часть времени на открытом воздухе. В наши дни многие люди работают в помещении, сидя за столом при искусственном освещении.Исследователи обнаружили, что всего пять минут на свежем воздухе в естественной обстановке могут улучшить настроение, повысить мотивацию и повысить самооценку. Время, проведенное на солнце, коррелирует с синтезом серотонина и дофамина. Даже короткая прогулка по парку может улучшить ваше самочувствие.
( Подробнее : 5 способов, которыми природа может помочь вам улучшить самочувствие)
3. Питание
Диета также может влиять на психическое здоровье. Кофе увеличивает уровень серотонина и дофамина… до тех пор, пока вы его принимаете.Как только вы перестанете пить кофе, у вас наступит ломка. Ваш мозг, привыкший к высокому уровню нейротрансмиттеров, будет вести себя так, как будто есть дефицит. Чтобы мозг вернулся в нормальное состояние, может потребоваться до 12 дней диеты без кофеина.
Жирные кислоты омега-3 повышают уровень серотонина без отмены. Они помогают серотонину запускать рецепторы нервных клеток, облегчая транспортировку. Многие исследования показали, что омега-3 помогают уменьшить симптомы депрессии. Омега-3 можно найти в холодноводной рыбе, такой как лосось.
Вопреки слухам в Интернете, поедание индейки не повышает уровень серотонина в мозге. Многие люди думают, что продукты, богатые триптофаном, могут улучшить настроение, поскольку мозг использует триптофан для производства серотонина. Однако триптофан конкурирует с несколькими другими аминокислотами за транспортировку в мозг. Поскольку он находится на низком уровне в списке приоритетов тела, он обычно проигрывает.
Тем не менее, наличие триптофана в вашем рационе очень важно. Если у вас его недостаточно, уровень серотонина упадет.Если вам нужно больше триптофана, вы можете получить его, употребляя крахмалистые продукты, такие как цельнозерновой хлеб, картофель и кукурузу.
( Подробнее: Продукты для хорошего настроения, помогающие бороться с депрессией, стрессом и т. Д.)
4. Медитация
Медитация — это практика расслабленного и сосредоточенного созерцания. Часто сопровождается дыхательными упражнениями. Факты показали, что медитация увеличивает выброс дофамина. Он может снять стресс и вызвать чувство внутреннего покоя.
( Подробнее: Снижение стресса: медитация осознанности для начинающих)
5.Благодарность
Научные исследования показали, что благодарность влияет на систему вознаграждения мозга. Это коррелирует с высвобождением дофамина и серотонина. Благодарность напрямую связана с увеличением счастья.
Было проведено множество исследований практики, называемой «упражнением трех благословений». Каждую ночь в течение недели вы записываете три вещи, за которые вы благодарны. Люди, выполняющие это упражнение, обычно сообщают о большем счастье и меньшем количестве депрессивных симптомов. Их улучшенное настроение может длиться до полугода.
( Подробнее: Как простая банка каменщика может принести больше благодарности в вашу жизнь)
6. Эфирные масла
Все эфирные масла получают из растений. Эти масла часто обладают лечебными свойствами. Одно исследование показало, что эфирные масла бергамота, лаванды и лимона обладают особенно лечебными свойствами. Используя ваше обоняние, они побуждают ваш мозг выделять серотонин и дофамин.
Примечание. Всегда следуйте инструкциям на этикетке бутылки. Хотя эфирные масла «натуральные», некоторые из них могут быть опасны при неправильном использовании.Не позволяйте маленьким детям играть с эфирными маслами.
( Подробнее: Как ароматерапия может улучшить психологическое и физическое здоровье)
7. Достижение цели
Когда мы достигаем одной из наших целей, наш мозг выделяет дофамин. Мозг считает этот выброс дофамина очень полезным. Он ищет больше дофамина, работая над другой целью.
Большие цели обычно сопровождаются повышенным уровнем дофамина. Однако лучше начинать с небольших целей, чтобы повысить свои шансы на успех.Краткосрочные цели могут складываться для достижения долгосрочной цели (и большего вознаграждения). Этот паттерн удерживает постоянный выброс дофамина в вашем мозгу.
( Подробнее: Как положительные утверждения могут помочь вам в достижении целей)
8. Счастливые воспоминания
Исследователи изучили взаимодействие между настроением и памятью. Они сосредоточились на передней поясной части коры головного мозга, области мозга, связанной с вниманием. Люди, переживающие печальные воспоминания, вырабатывали меньше серотонина в этом регионе.Люди, живущие в счастливых воспоминаниях, производят больше серотонина.
( Подробнее: Можем ли мы целенаправленно сохранить воспоминания навсегда?)
9. Новинка
Мозг реагирует на новые переживания, выделяя дофамин. Вы можете естественным образом увеличить уровень дофамина, ища новых впечатлений. Подойдет любой опыт. Вы можете сделать что-нибудь простое, например, новое хобби или рецепт. Или вы можете попробовать что-нибудь грандиозное, например, прыжки с парашютом. Чем меньше вы знакомы с этим занятием, тем больше вероятность, что ваш мозг вознаградит вас дофамином.
( Подробнее: 5 вещей в моем новогоднем списке для моих детей)
10. Терапия
Исследования показывают, что изменение настроения может повлиять на синтез серотонина в мозгу. Это означает, что настроение и синтез серотонина взаимно влияют друг на друга. Психотерапия часто помогает людям улучшить настроение. Возможно, терапия также может помочь повысить уровень серотонина.
( Подробнее : Преимущества терапии)
Хотя эти 10 методов могут повысить ваши нейротрансмиттеры, они не заменяют медицинскую помощь.Если у вас есть проблемы с психическим здоровьем, вам всегда следует обращаться к врачу или терапевту. Специалист в области психического здоровья может сказать вам, какие подходы лучше всего подходят для вашей конкретной ситуации. Нет ничего постыдного в том, чтобы принимать лекарства или посещать консультации. Это распространенные варианты лечения среди многих.
Артикул:
© Copyright 2017 GoodTherapy.org. Все права защищены.
Предыдущая статья была написана исключительно указанным выше автором. Любые высказанные взгляды и мнения не обязательно разделяются GoodTherapy.org. Вопросы или замечания по предыдущей статье можно направить автору или опубликовать в комментариях ниже.
Дофамин и серотонин в мозге различаются по регуляции и ее последствиям
Abstract
Дофамин и серотонин (5-гидрокситриптамин или 5-HT) являются нейротрансмиттерами, которые участвуют во многих психологических расстройствах.Хотя передача дофамина в головном мозге широко изучалась in vivo с помощью циклической вольтамперометрии с быстрым сканированием, обнаружение 5-HT с использованием вольтамперометрических методов in vivo было установлено только недавно. В этой работе мы используем два микроэлектрода из углеродного волокна для одновременного измерения высвобождения дофамина в прилежащем ядре и высвобождения 5-HT в ретикулатной части черной субстанции, используя обычную стимуляцию у одной крысы. Мы обнаружили, что высвобождение 5-HT существенно ограничено по сравнению с высвобождением дофамина, несмотря на сопоставимые уровни содержания в тканях.Используя физиологический и фармакологический анализ, мы обнаружили, что передача 5-HT наиболее чувствительна к механизмам поглощения и метаболической деградации. Напротив, передача дофамина ограничивается синтезом и переупаковкой. Наконец, мы показываем, что нарушение серотонинергических регуляторных механизмов путем одновременного ингибирования захвата и метаболической деградации может иметь серьезные физиологические последствия, имитирующие серотониновый синдром.
Дофамин и серотонин (5-гидрокситриптамин или 5-HT) являются нейротрансмиттерами, играющими важную консервативную роль в нервной системе позвоночных.Дофамин важен в нейронных цепях, контролирующих вознаграждение, и в областях мозга, регулирующих движения (1). Приписать 5-HT определенную функциональную роль оказалось сложнее, поскольку электрофизиологические записи нейронов 5-HT показывают неизменное возбуждение в ответ на большинство стимулов (2). Конкурирующие роли были предложены для дофамина и 5-HT в схеме вознаграждения, при этом сигналы дофамина предсказывают положительные стимулы, а сигналы 5-HT предсказывают отрицательные последствия (3, 4). Биохимически их регуляция весьма схожа: схожие белки регулируют синтез, хранение, высвобождение, поглощение и метаболизм.Для сравнения функциональной регуляции дофамина и 5-HT в головном мозге были разработаны методы мониторинга динамических изменений их концентраций во внеклеточном пространстве.
Преходящие колебания концентрации дофамина во внеклеточном пространстве ядра прилежащего ядра (NAc) могут быть вызваны электрической стимуляцией медиального пучка переднего мозга (MFB) и были охарактеризованы у крыс с помощью вольтамперометрических методов in vivo (5, 6) . Дофамин легко окисляется, и для его обнаружения можно использовать электрохимические методы, такие как циклическая вольтамперометрия с быстрым сканированием (7).Микроэлектрод из углеродного волокна помещается в интересующую область мозга. Форма циклической вольтамперограммы определяет дофамин, и ее амплитуда может использоваться для расчета концентрации. Каждая циклическая вольтамперограмма может быть получена менее чем за 10 мс, что обеспечивает быстрое повторное получение данных. Последовательные записи колебаний концентрации дофамина приводят к визуализации событий дофаминергической передачи с субсекундным временным разрешением. Этот метод показал, что электрическая стимуляция дофаминергических аксонов немедленно вызывает выброс дофамина, который быстро поглощается переносчиком дофамина (DAT).Во время поведения получение неожиданного вознаграждения (8) или подсказок, предсказывающих вознаграждение (9), приводит к временным изменениям концентрации дофамина. Эти переходные процессы возникают из-за спонтанного возбуждения дофаминергических нейронов в вентральной тегментальной области и регулируются теми же механизмами, что и электрически вызванное высвобождение (10).
Подобные субсекундные характеристики передачи 5-HT возможны, потому что 5-HT также легко окисляется. Однако вольтамперометрическое обнаружение 5-HT осложняется продуктами окисления, которые загрязняют поверхность электрода, снижая чувствительность и временное разрешение (11).Кроме того, 5-гидроксииндолуксусная кислота (5-HIAA), основной метаболит 5-HT, может аналогичным образом разрушать поверхность электрода. Чтобы свести к минимуму эти проблемы, мы изменили форму сигнала обнаружения, чтобы предотвратить образование продуктов окисления, загрязняющих поверхность электрода. Мы также гальванически наносим катионообменный полимер Nafion на углеродное волокно для снижения чувствительности к 5-HIAA (12, 13). Используя эти модификации, мы продемонстрировали, что стимулированное высвобождение 5-HT может быть измерено в ретикулированной части черной субстанции (SNr) путем стимуляции MFB (14) в месте, которое также вызывает высвобождение дофамина (5).
Эта работа характеризует и сравнивает факторы, регулирующие внеклеточные концентрации 5-HT и дофамина. Собственные разработки оборудования и программного обеспечения позволяют применять две разные формы волны на разных электродах в разных областях мозга (15). Используя одновременные измерения дофамина и 5-HT, вызванные общей стимуляцией, оценивали физиологические и фармакологические манипуляции с амплитудой высвобождения и свойствами поглощения. Мы обнаружили, что совершенно разные процессы управляют динамикой дофамина и 5-HT.Взятые вместе, эти результаты показывают, что механизмы, контролирующие 5-HT во внеклеточном пространстве, более жесткие, чем механизмы дофамина.
Результаты
Одновременное высвобождение дофамина и 5-HT, вызванное общей стимуляцией.
Микроэлектрод из углеродного волокна помещали в NAc каждой крысы и применяли форму волны дофамина. Второй микроэлектрод помещали в ипсилатеральный SNr и использовали форму волны 5-HT. Обе формы сигнала показаны на рис. 1, слева, .Высвобождение вызывалось в обеих областях мозга путем электрического стимулирования ипсилатерального MFB (60 Гц, длительность 2 с, двухфазные импульсы, 2 мс каждая фаза, 350 мкА), как показано на цветных диаграммах на рис. 1. Каждый цветной график кодирует 300 циклов. вольтамперограммы, записанные в течение 30 секунд вокруг стимуляции (начало через 5 секунд, вертикальная черная линия). Форма циклических вольтамперограмм (верхняя вольт-амперная кривая, рис. 1, , левая ), записанных в NAc и SNr, идентифицирует дофамин и 5-HT, соответственно. Поразительно, но амплитуда стимулированного дофамина примерно в 300 раз больше, чем у 5-HT.Скорость поглощения нейротрансмиттеров более сопоставима. Переносчики дофамина и 5-HT следуют кинетике Михаэлиса-Ментен. При низких концентрациях константа скорости поглощения дофамина в NAc ( k = V max / K m ) составляет ∼14 с −1 (16), а в SNr ∼4 с −1 для поглощения 5-HT (14).
Рис. 1.Слева : характерные цветные графики с потенциалом на оси y , временем на оси x и током в ложном цвете.Горизонтальная белая пунктирная линия использовалась для построения графиков зависимости тока от времени, нанесенных над цветными графиками. Начало стимуляции (пунктирная черная вертикальная линия) и продолжительность представлены синей полосой под графиками зависимости тока от времени. Вставки : Циклические вольтамперограммы, снятые по вертикальным белым пунктирным линиям. Справа : усредненные, нормализованные ответы, зарегистрированные в NAc (дофамин) и SNr (5-HT), когда стимулирующий электрод опускался вниз по вертикальному тракту к MFB ( n = 6).Звездочки указывают нормализованные значения максимального высвобождения 5-HT, которые значительно отличаются от соответствующих значений нормализованного высвобождения дофамина ( P <0,05).
Сначала мы исследовали высвобождение дофамина и 5-HT в зависимости от дорсовентрального положения стимулирующего электрода. Рис. 1, Справа показывает нормированную амплитуду вызванного 5-HT в SNr и дофамина в NAc, полученную при различных положениях стимулирующих электродов, когда она понижалась с шагом 0,5 мм от -6 до -10.5 мм через MFB. Звездочки указывают на то, что в этом месте произошло значительное высвобождение ( P <0,05). Высвобождение как 5-HT, так и дофамина было максимальным при длине стимулирующего электрода -8,5 мм. Профиль ответа 5-HT был шире, с измеряемым высвобождением на глубине стимулирующего электрода от 7,0 до 10,0 мм ниже твердой мозговой оболочки, тогда как дофамин мог быть зарегистрирован только между 8,0 и 9,0 мм ниже твердой мозговой оболочки.
Влияние параметров стимуляции на высвобождение.
Мы варьировали параметры стимула в MFB, чтобы изучить их влияние на высвобождение по сравнению с тем, которое было получено с нашими максимальными условиями (глубина, 8.5 мм от твердой мозговой оболочки, 60 Гц: длительность 2 с, двухфазные импульсы, 2 мс каждая фаза, 350 мкА). Дофамин и высвобождение 5-HT чувствительны к длительности импульса стимула (5), достигая максимума через 2 мс (рис. 2 A ). Высвобождение дофамина увеличивается с интенсивностью стимула до 350 мкА с импульсами длительностью 2 мс (17), и 5-HT реагирует аналогичным образом (рис. 2 B ). Стимулированное высвобождение дофамина уменьшается при быстром повторении стимуляции (18). Используя серию максимальной стимуляции, повторяемую каждую минуту, мы обнаружили, что высвобождение дофамина снижалось при последовательных стимуляциях, упав до 38% ± 7% от максимального нормализованного значения ( n = 6, P <0.05) после 20-й стимуляции (рис. 2 C ). Напротив, максимальное высвобождение 5-HT не показывало признаков истощения.
Рис. 2.Усредненное, нормализованное максимальное высвобождение дофамина и 5-HT с ( A ) вариацией ширины импульса стимуляции и ( B ) амплитудой тока стимуляции ( n = 6 для каждого передатчика). ( C ) Усредненные, нормализованные ответы дофамина и 5-HT на повторяющиеся серии стимуляции ( n = 6). Стимуляция представляла собой 120 двухфазных импульсов с частотой 60 Гц, 350 мкА и 2 мс, подаваемых каждые 60 с в течение 20 мин.
Фармакология синтеза, упаковки, высвобождения, поглощения и метаболизма.
Различные аспекты передачи дофамина, включая синтез (5), упаковку (19), ауторецепторную регуляцию высвобождения (6), поглощения (16, 20) и метаболизма (21), были охарактеризованы с помощью фармакологии и вольтамперометрии in vivo. В этом исследовании мы сравнили дофаминергические и серотонинергические реакции на эти манипуляции. Усредненные реакции стимулированного высвобождения 5-HT перед лекарством и лекарственным средством показаны на фиг. 3 и 4 ( верхний ), а ответы для дофамина на эквивалентное лечение показаны непосредственно ниже ( верхний средний ).Гистограммы с амплитудой и t 1/2 (оба выражены относительно значения до введения лекарства) показаны на фиг. 3 и 4 ( нижний средний и нижний ) соответственно. Если ответ на фармакологическое лечение значительно отличается от ответа на лечение препаратом, статистическая значимость ( P <0,05) отмечена звездочкой. Продолжительность стимуляции обозначена горизонтальными полосами под каждым графиком зависимости концентрации от времени.
Рис. 3.Сравнение усредненных ответов 5-HT в SNr ( Top ; n = 5) и дофамина в NAc ( Upper Middle ; n = 6) на фармакологическое ингибирование синтеза , упаковка и выпуск (слева направо).Синтез ингибировался с помощью NSD 1015, а везикулярная упаковка ингибировалась тетрабеназином. Высвобождение увеличивалось антагонистами ауторецепторов (метиотепин для 5-HT и раклоприд для дофамина). Нижний Средний и Нижний : Гистограммы процентного изменения амплитуды и t 1/2 , вызванного лекарственным средством через 60 минут после его введения. Звездочки на гистограмме указывают на существенное изменение значений до приема лекарства ( P <0,05).
Фиг.4.Сравнение усредненных ответов 5-HT в SNr ( Top ; n = 5) и дофамина в NAc ( Upper Middle ; n = 6) на фармакологическое ингибирование поглощения и метаболизма МАО. Поглощение ингибировалось GBR 12909 для дофамина и циталопрама для 5-HT. Паргилин ингибировал МАО и эффективен для обоих нейромедиаторов. Нижний Средний и Нижний : Гистограммы, отображающие процентное изменение амплитуды и t 1/2 .Звездочки на гистограмме указывают на существенное изменение значений до приема лекарства ( P <0,05).
Мы исследовали влияние синтеза на дофамин и высвобождение 5-HT путем введения NSD 1015 (100 мг кг -1 ), ингибитора декарбоксилазы ароматических аминокислот (рис. 3, слева, ). Ингибирование декарбоксилазы приводит к накоплению 1-ДОФА и 5-гидрокситриптофана (22). Через шестьдесят минут после введения NSD 1015 высвобождение дофамина снизилось до 18,0% ± 4,5% от его первоначальной амплитуды ( n = 6, P <0.05). Напротив, высвобождение 5-HT было снижено до 48,1% ± 2,8% от его амплитуды до обработки в тот же момент времени ( n = 6, P <0,01). Не наблюдалось значительных эффектов NSD 1015 на t 1/2 дофамина или 5-HT.
Дофамин и 5-HT высвобождаются посредством экзоцитоза из везикулярных хранилищ. Мы исследовали значение быстрой везикулярной упаковки в обеих системах, сравнивая эффекты ингибитора везикулярного транспортера моноаминов 2 (VMAT2), тетрабеназина (10 мг кг -1 ) (23, 24).Тетрабеназин значительно снижал высвобождение дофамина до 6,3% ± 3,0% от его значения перед лекарством через 60 минут после введения ( n = 5, P <0,05; рис. 3, Center ). Эффекты на высвобождение 5-HT не были значительными (71,6% ± 8,8% от значения до введения лекарства; n = 5). Однако время задержки между началом стимуляции и максимальным сигналом увеличилось с 2,21 ± 0,15 с до 3,52 ± 0,34 с ( n = 5, P <0,05) после введения тетрабеназина. Тетрабеназин снижает высвобождение дофамина почти до предела обнаружения; следовательно, анализ t 1/2 на предмет статистической значимости был невозможен. t 1/2 5-HT был значительно увеличен с 1,9 + 0,25 с до 2,59 ± 0,43 с (135% ± 21% от исходного; n = 5, P <0,05).
Чтобы исследовать ауторецепторный контроль высвобождения на 5-HT концах в SNr, мы вводили метиотепин (20 мг кг -1 ), неселективный антагонист рецепторов 5-HT 1a и 1b (25). Стимулированное высвобождение 5-HT увеличилось до 161% ± 10% от исходного (рис.3, справа ) ( n = 6, P <0.05). Мы вводили раклоприд, антагонист рецептора D2, чтобы изучить эффекты ауторецепторов в дофаминергической системе (26). Раклоприд (2 мг / кг -1 ) увеличивал стимулированное высвобождение дофамина до 184% ± 34% ( n = 6, P <0,05) от значения перед лекарственным средством. Хотя раклоприд не оказал значительного воздействия на t 1/2 для дофамина, метиотепин значительно увеличил t 1/2 для 5-HT, с 1,36 ± 0,17 с до 1,99 ± 0,24 с ( n = 6 , P <0.05).
Фиг. 4, Слева показывает эффекты ингибирования транспортера захвата 5-HT (SERT) и DAT. SERT подавлялся селективным ингибитором обратного захвата серотонина циталопрамом (10 мг кг -1 ) (27), тогда как GBR 12909 (15 мг кг -1 ) использовался для ингибирования DAT (28). Циталопрам значительно увеличил амплитуду стимулированной 5-HT до 476% ± 134% от исходного значения ( n = 6, P <0,05) и значительно увеличил t 1/2 , с 2.От 27 ± 0,07 с до 7,35 ± 1,46 с ( n = 6, P <0,05). GBR 12909 значительно увеличил амплитуду стимулированного дофамина до 279% ± 70% от его значения перед лекарством ( n = 6, P <0,05) и значительно увеличил t 1/2 , с 0,86 ± 0,14 с до 2,12 с. ± 0,2 с ( n = 6, P <0,05).
Рис. 4, Справа сравнивает эффекты ингибирования моноаминоксидазы (МАО) паргилином (75 мг кг -1 ) на дофамин и 5-HT-стимулированное высвобождение (21).Амплитуда высвобождения 5-HT увеличилась до 349% ± 60% от исходного значения ( n = 6, P <0,05), тогда как высвобождение дофамина существенно не увеличилось (175,1% ± 27,3%; n = 6, P > 0,05). Не было значительных эффектов паргилина на дофамин t 1/2 ; однако 5-HT t 1/2 значительно увеличился с 1,58 ± 0,07 с до 2,97 ± 0,49 с ( n = 6, P <0,05).
SSRI и MAOI администрации.
На Фиг.5 показан спонтанный отток дофамина (Фиг.5 A ) и 5-HT (Фиг.5 B ), происходящий после остановки дыхания, вызванной введением циталопрама (10 мг / кг -1 ) с последующим паргилин (150 мг, кг -1 ). Концентрация оттока дофамина на пике составляла в среднем 37,7 ± 3,4 мкМ ( n = 4), тогда как отток 5-HT был значительно ниже при 0,296 ± 0,080 мкМ ( n = 4, P <0,001) (рис. 5 С ). Время, прошедшее между началом и пиком оттока, также значительно различается, составляя в среднем 77 ± 4 с для дофамина и 266 ± 50 с для 5-HT ( n = 4 для каждого, P <0.01) (Рис.5 F ). Рис.5 D и E сравнивают реакцию на температуру тела и частоту сердечных сокращений между анестезированными крысами, которые получали электрическую стимуляцию и две инъекции физиологического раствора с интервалом 35 минут ( n = 4, белый) или электростимуляцию с последующим введением циталопрама (T1 ) и паргилин (Т2) ( n = 6, черный). Введение паргилина совпадает со значительным снижением температуры тела (фиг.5 D ) и частоты сердечных сокращений (фиг.5 E ), которое сохраняется на протяжении оставшейся части эксперимента ( P <0.05).
Рис. 5.Эффекты циталопрама и паргилина. ( A и B ) Репрезентативные результаты у отдельных животных для оттока дофамина (NAc) и 5-HT (SNr), которые оба происходят спонтанно сразу после остановки дыхания. ( C ) Максимальные концентрации дофамина и 5-HT ( n = 4 для каждого). ( D ) Реакция температуры тела относительно исходного уровня (0-25 мин) во время электростимуляции (шесть 2-секундных стимуляций с интервалом 5 мин, ES), после циталопрама (T1) и после паргилина (T2).Животные, получавшие лекарственное средство, показаны закрашенными кружками ( n = 6), а контрольные животные, обработанные физиологическим раствором, показаны светлыми кружками ( n = 4). ( E ) Реакция частоты сердечных сокращений на электрическую стимуляцию (ES), циталопрам (T1) и паргилин (T2). Животные, получавшие лекарственное средство, показаны закрашенными столбцами ( n = 4), контроли с физиологическим раствором показаны белыми столбцами ( n = 4). ( F ) Среднее время между началом оттока и пиком оттока для дофамина и 5-HT ( n = 4). Звездочки указывают на существенные различия между группами (* P <0.05; ** P <0,01; *** P <0,001).
Обсуждение
Регулирование выброса 5-HT более жесткое, чем для допамина.
В этой работе электрическая стимуляция MFB одновременно вызвала высвобождение дофамина в NAc и высвобождение 5-HT в SNr. Стимуляция в одном месте, высвобождающем разные нейротрансмиттеры, позволяет сравнить динамические изменения в их регуляторных механизмах (29). Особенно примечательным открытием было то, что высвобождение дофамина было примерно в 300 раз больше, чем высвобождение 5-HT, несмотря на аналогичное содержание ткани в двух исследованных областях [90 нг / мг белка для дофамина в NAc (16) и 21 нг мг -1 белок для 5-HT в SNr (30)].Таким образом, несмотря на сопоставимые запасы, высвобождаемый пул 5-HT в SNr ничтожен по сравнению с высвобождаемым пулом дофамина в NAc. Были описаны отдельные пулы хранения и высвобождения как для 5-HT, так и для дофамина (31, 32), но большая разница в их относительном размере ранее не оценивалась. Более того, мы ранее отмечали, что вызванное высвобождение 5-HT в SNr намного ниже in vivo по сравнению с его электрически вызванным высвобождением из препаратов срезов SNr (14). Это говорит о том, что высвобождение 5-HT in vivo регулируется более жесткими механизмами контроля, чем как 5-HT в срезах, так и дофамин in vivo.
Чтобы определить возможные механизмы этих различий, мы исследовали эффекты электростимуляции на дофаминовые и 5-HT аксоны, которые проходят через MFB. Пучки дофаминергических и серотонинергических волокон реагировали аналогично тестируемым параметрам стимуляции, давая большее высвобождение с помощью широких электрических импульсов и больших амплитуд тока (рис. 2). Эти свойства согласуются с нашими прогнозами, учитывая, что оба волокна немиелинизированы (33, 34). Изменение дорсовентрального расположения стимулирующего электрода показало, что высвобождение 5-HT может быть вызвано в большей области, чем дофамин, что позволяет предположить, что серотонинергические волокна имеют более широкое топографическое распределение.Однако этого недостаточно для объяснения 300-кратного увеличения высвобождения дофамина, потому что даже прямая стимуляция тел серотонинергических клеток в дорсальном шве вызывает сравнительно низкое высвобождение 5-HT (14).
Несоответствие между амплитудами высвобождения 5-HT и дофамина объясняется различиями в легко высвобождаемом пуле. Высвобождение дофамина было чувствительным к повторяющемуся применению последовательностей стимуляции, проявляя усталость при высвобождении, чего не было для 5-HT в SNr. Уменьшение высвобождения дофамина после повторных стимуляций связывают с истощением высвобождаемого пула (35).Напротив, некоторое количество 5-HT может храниться в плотных сердцевинных везикулах (36) или других компартментах, которые не подвергаются экзоцитозу. Это даст эффекты, соответствующие небольшому количеству 5-HT, доступного для выпуска.
Высвобождение дофамина чувствительно к синтезу и упаковке, тогда как 5-HT является системой с контролируемым поглощением / метаболизмом.
Некоторые фармакологические агенты, исследованные в этой работе (рис. 3 и 4), ингибируют одни и те же процессы в дофаминергических и серотонинергических нейронах. Например, ингибирование декарбоксилазы ароматических аминокислот с помощью NSD 1015 подавляет синтез как 5-HT, так и дофамина (22).Поскольку предыдущие эксперименты предполагают, что высвобождаемый пул дофамина более чувствителен к истощению, мы предсказали, что высвобождаемый 5-HT также будет менее чувствительным к ингибированию синтеза, и было обнаружено, что это так. 5-HT и дофамин упаковываются в везикулы под действием VMAT2 (37), и ингибирование этого переносчика тетрабеназином привело к большему снижению высвобождения дофамина, чем 5-HT. Мы предполагаем, что меньший выпускаемый пул способствует более низкой амплитуде высвобождения, что, в свою очередь, снижает потребность в упаковке в серотонинергических терминалах.Это подтверждается сравнительно умеренной реакцией 5-HT на манипуляции, влияющие на синтез и упаковку. Однако было значительное увеличение т 1/2 для 5-HT зазора. Увеличение цитоплазматического 5-HT, вызванное ингибированием VMAT2, может снизить скорость захвата, изменяя зависящую от концентрации движущую силу для SERT, общей особенности переносчиков аминов (38). Была задержка начала высвобождения 5-HT, которая может указывать на нечувствительные к тетрабеназину везикулярные пулы, возможно, плотные сердцевинные везикулы, компенсирующие потребность при высвобождении.
После высвобождения одной судьбой моноаминов является метаболическая деградация под действием МАО (39). Предыдущие исследования показали, что есть небольшое увеличение высвобождения дофамина после ингибирования МАО, предположительно потому, что переупаковка в пузырьки становится более вероятной во время снижения метаболической деградации (21). Однако увеличение стимулированного высвобождения 5-HT после ингибирования МАО более чем в три раза, что указывает на то, что серотонинергические нейроны лучше регулируются МАО. Более того, в то время как ингибирование МАО не влияло на скорость клиренса дофамина, значительное увеличение t 1/2 сигнала 5-HT указывает на то, что это лечение вызвало снижение скорости обратного захвата 5-HT.Подобно ингибированию VMAT2, ингибирование МАО может изменять движущую силу SERT, что приводит к снижению скорости поглощения.
Еще одним средством внеклеточной регуляции является захват через транспортеры. Однако, поскольку разные рецепторы и переносчики регулируют высвобождение дофамина и 5-HT, необходимо было вводить разные агенты для оценки этих контрольных точек. Мы обнаружили, что обе системы нейротрансмиттеров были чувствительны к избирательному ингибированию их переносчиков (рис. 4 D ), результаты согласуются с предыдущей работой (27, 40).Известно, что ауторецепторы серотонина подавляют высвобождение 5-HT аналогично регуляции высвобождения дофамина ауторецепторами дофамина в NAc (41–43). Мы использовали метиотепин, неселективный антагонист ауторецепторов 5-HT, для нацеливания на множественные ауторецепторы 5-HT (44). После приема раклоприда и метиотепина высвобождение дофамина и 5-HT, соответственно, умеренно увеличивалось. Это говорит о том, что регуляция 5-HT ауторецепторов не отвечает за различия между 5-HT и высвобождением дофамина.Увеличение t 1/2 сигнала 5-HT после введения метиотепина согласуется с предположением Daws et al. (45, 46), что авторецепторы 5-HT 1B модулируют клиренс 5-HT.
Нарушение механизмов контроля 5-HT приводит к серотониновому синдрому.
В течение 2,5 ч после ингибирования SERT и МАО остановка дыхания сопровождалась спонтанным оттоком дофамина и 5-HT (фиг. 5 A и B ). Синхронизированный отток дофамина и 5-HT, вероятно, отражает обращение их транспортеров, которые используют вторичный активный транспорт, связанный с чувствительной к дыханию Na + / K + АТФазой (38).Спонтанный отток, предшествующий смерти, напоминает вызванное высвобождение в том смысле, что максимальная амплитуда 5-HT намного ниже, чем для дофамина (рис. 5 C ). Более того, отток 5-HT продлен (Fig. 5 D ), добавляя поддержку концепции о том, что 5-HT более жестко ограничивается нейронами. После циталопрама введение паргилина привело к снижению частоты сердечных сокращений и температуры тела, что в конечном итоге привело к смерти (рис. 5 D и E ). Эти результаты согласуются с предыдущими сообщениями о том, что комбинированное введение ингибиторов МАО и SERT, но не DAT, приводит к летальному исходу у крыс (47).Известно, что у людей эта фармакологическая комбинация вызывает серотониновый синдром, который возникает из-за избыточной серотонинергической активности в центральной нервной системе (48–50). Наши результаты раскрывают последствия серотонинового синдрома у животных, находящихся под наркозом.
Выводы
В предыдущей работе мы использовали аналогичный сравнительный подход для сравнения высвобождения норэпинефрина и дофамина, вызванного единственной стимуляцией, и обнаружили, что их характеристики высвобождения и поглощения были довольно схожими (29).В этой работе записи с высоким временным разрешением выявили гораздо большие различия в регуляции дофамина и 5-HT. Мы обнаружили, что высвобождение 5-HT строго регулируется и в основном определяется системами обратного захвата / инактивации, которые невозможно разгадать с помощью более медленных методов мониторинга, таких как микродиализ. Кроме того, с помощью электрохимического мониторинга выявлены нейрохимические процессы, происходящие в результате летального исхода серотонинового синдрома.
Методы
Полные экспериментальные процедуры представлены в SI Методы .
Хирургические процедуры.
Стереотаксические операции для вольтамперометрических измерений были выполнены, как описано ранее (12). Вкратце, модифицированные Nafion микроэлектроды из углеродного волокна были имплантированы в SNr и в NAc. Биполярный стимулирующий электрод из нержавеющей стали был имплантирован в MFB. Как уже отмечалось, у некоторых животных отслеживали частоту сердечных сокращений, дыхание и температуру тела ( SI Methods ).
Вольтамперометрические процедуры.
Quad Universal Electrochemical Instrument (UEI) потенциостаты, описанные ранее (15), были изменены путем включения независимого управления потенциалом на двух парах операционных усилителей в головном каскаде.Система сбора данных, способная генерировать два независимых сигнала и собирать данные из двух наборов каналов, была описана ранее (15). Все указанные потенциалы относятся к Ag / AgCl.
Лекарства и реактивы.
Фаргилин гидрохлорид фармацевтического качества, NSD 1015 (дигидрохлорид 3-гидроксибензилгидразина), GBR 12909 дигидрохлорид, раклоприд, метиотепин, циталопрам и тетрабеназин вводили внутрибрюшинно.
Анализ данных.
Двусторонние тесты Стьюдента t были выполнены на парных наборах данных. P <0,05 было принято за достоверное. Планки погрешностей указаны как ± SEM. Двусторонний дисперсионный анализ ANOVA использовался для анализа температуры тела и частоты сердечных сокращений.
Благодарности
Мы благодарим Университет Северной Каролины на кафедре химии и электроники в Чапел-Хилл, который разработал и изготовил приборы для этих экспериментов. Это исследование было поддержано грантом NS15841 Национальных институтов здравоохранения (R.M.W.).
Сноски
Серотонин и дофамин связаны с принятием решений: исследование
Давно связанные с вознаграждением и удовольствием, дофамин и серотонин также могут быть вовлечены в общее познание, формируя то, как люди воспринимают мир и действуют в соответствии с этими представлениями, показало новое исследование. .
Впервые исследователи непрерывно и одновременно наблюдали за двумя нейромодуляторами в человеческом мозге. Результаты, опубликованные 12 октября в журнале Neuron , предлагают новые возможности для проверки гипотез, ранее изученных в основном на животных моделях.
«Это исследование не просто измерение дофамина и серотонина; он строится на глубоком фундаменте изучения нейронных механизмов для принятия решений у животных и людей »и связывая результаты этих исследований вместе, Тим Хэнкс, нейробиолог из Калифорнийского университета в Дэвисе, который не принимал участия в исследовании, говорит Ученый .«Растет признание того, что [дофамин и серотонин] играют более тонкую и тонкую роль, чем то, что когда-то предполагалось, и это исследование действительно проясняет этот случай при принятии решений человеком».
Оба нейромодулятора были тщательно изучены на животных, но животные требуют обучения, чтобы выполнять задачи по принятию решений — обучение, которое часто сопровождается вознаграждением. В результате бывает трудно отделить принятие решений от подкрепления, которое они получают взамен. «Животные — это ограниченная модель богатых мыслей и поведения, которые мы наблюдаем у людей», — говорит Дэн Бэнг, нейробиолог из Университетского колледжа Лондона и ведущий автор нового исследования.
См. «Как дофамин настраивает рабочую память».
Для изучения передачи сигналов дофамина и серотонина у людей команда набрала пять добровольцев, которым была назначена операция на головном мозге для лечения тремора Паркинсона или эссенциального тремора, и согласились контролировать их нейрохимические вещества во время процедуры. . Хирурги не дают пациентам спать во время операции и в целях безопасности используют датчики для измерения активности мозга. Исследовательская группа, возглавляемая Ридом Монтегю, нейробиологом из Технологического института Вирджинии, смогла вставить собственный микроэлектрод в хвостатое ядро четырех добровольцев и скорлупу пятого.Обе структуры являются областями полосатого тела и участвуют в движении, обучении и вознаграждении.
Это определенно выводит важность дофамина и серотонина в новый свет.
—Кен Кишида, Медицинская школа Уэйк Форест
Во время операции каждый участник выполнил модифицированную версию общей визуальной задачи, называемой парадигмой случайного движения точек. В каждом раунде задания человеку показывали облако мерцающих точек, движущихся по экрану.Некоторые точки перемещались вместе в одном направлении, а остальные перемещались беспорядочно; пропорции, которым подвергается каждый тип движения, определяли сложность задания. В стандартном тесте точки исчезают, и испытуемый должен указать, двигались ли они в среднем влево или вправо. В измененном протоколе участникам вместо этого показали случайный угол после того, как точки исчезли, и они должны были решить, двигались ли точки влево или вправо от этого угла.
Таким образом, ученые смогли варьировать сложность и неопределенность восприятия человека, изменяя как количество точек, движущихся синхронно, так и то, насколько близок их путь движения к случайно выбранному опорному углу. Сделав свой выбор, участники оценили, насколько они уверены в своем решении.
Микроэлектрод непрерывно измерял уровни дофамина и серотонина в хвостатом ядре или скорлупе, делая 10 измерений каждую секунду. Ученые никогда раньше не могли контролировать эти нейротрансмиттеры с такой биологически значимой скоростью у людей.Менее инвазивные методы, такие как ПЭТ-сканирование или фМРТ, обычно проводят только одно измерение в минуту.
Зонд, использованный в исследовании (вверху, показан скрепкой для сравнения размеров), изготовлен из углеродного волокна и использует низкие напряжения для определения активности дофамина и серотонина в реальном времени.
virginia tech
В хвостатом ядре уровни серотонина были связаны с неопределенностью восприятия у трех из четырех участников. Когда задача была более сложной, а результат более неопределенным, как оценивали переменные задачи и неуверенность участников в своих решениях, уровень серотонина резко повышался вскоре после того, как точки появлялись на экране.Когда задача была легче, серотонин упал. В некоторых предыдущих исследованиях на людях и животных дофамин имел противоположную связь с серотонином и, следовательно, с неопределенностью, но в новом исследовании изменения в уровнях дофамина в хвостатом ядре не отслеживались согласованно с неопределенностью восприятия.
В случае скорлупы, однако, команда нашла убедительные доказательства в поддержку противоположных ролей дофамина и серотонина по отношению к действию, о чем свидетельствует время, которое потребовалось участникам, чтобы сделать свой выбор относительно направления точек.Как увеличение дофамина, так и соответствующее снижение серотонина были связаны с выбором субъекта действовать, и как изменение уровней нейромодулятора, так и само решение происходили быстрее, когда задача была легче и менее неопределенной.
Взятые вместе, эти результаты предполагают, что, помимо своей роли как химические вещества для поощрения, дофамин и серотонин могут способствовать познанию в более общем плане, связывая «то, как мы воспринимаем мир и как мы затем принимаем решения», — говорит Кен Кишида, нейробиолог. в Медицинской школе Уэйк Форест и соавтором исследования.«Это определенно выводит важность дофамина и серотонина в новый свет».
Несмотря на то, что это новое открытие у людей, оно согласуется с тем, что некоторые исследователи начали находить у животных, говорит Армин Лак, нейробиолог из Оксфордского университета, не принимавший участия в исследовании. В своей собственной работе Лак обнаружил связь между дофамином и восприятием у грызунов. «Для тех из нас, кто работает в области нейробиологии, действительно приятно видеть весь спектр исследований, от животных до людей-добровольцев.
См. «Дофаминовые нейронные имплантаты облегчают симптомы болезни Паркинсона у обезьян»
Самым большим ограничением нового исследования, добавляет Лак, является небольшой размер выборки. Некоторые результаты команды, например данные о скорлупе, получены только от одного человека. Кишида также отмечает, что, хотя уровни дофамина у разных людей различались больше, чем уровни серотонина, это может быть связано с тем, что у некоторых пациентов была болезнь Паркинсона, болезнь, вызванная нарушением регуляции передачи сигналов дофамина.
В дальнейшем команда планирует усовершенствовать свой микроэлектрод для распознавания дополнительных нейрохимических веществ, таких как норадреналин.Показав, что ответы нейромодуляторов могут различаться в зависимости от области мозга, они также хотели бы расширить, включив кору, миндалину и гиппокамп.
Лучшее понимание того, как взаимодействуют дофамин и серотонин и их роль в различных частях мозга, также будет иметь важное значение для лечения психоневрологических расстройств, таких как болезнь Паркинсона и депрессия, говорит Хэнкс. Многие методы лечения нацелены на эти два модулятора, но они воздействуют на весь мозг и в более длительных временных масштабах, поэтому дополнительные знания могут привести к более целенаправленным и эффективным методам лечения.
«Поскольку у этих нейромодуляторов есть сложные роли, которые зависят от области мозга, некоторые сочтут это проблемой, потому что это означает, что мы не можем просто использовать лекарство, которое влияет на [мозг] диффузно», — говорит Хэнкс The Scientist . «Но в то же время я бы сказал, что это прекрасная возможность сделать [терапию] еще более эффективной».
Д. Банг и др., «Субсекундная передача сигналов дофамина и серотонина в полосатом теле человека во время принятия решений», Neuron , 108: 1–12, 2020.
Уточнение (16 октября): название этой статьи было обновлено, чтобы лучше отразить результаты исследования, и было внесено исправление, чтобы уточнить, что уровни серотонина повышались в хвостатом ядре, когда участники были более неуверенными.
Nutri Advanced | Дофамин и серотонин: у вас дефицит этих ключевых нейротрансмиттеров?
Воспитать в себе счастливый, спокойный и мотивированный ум, который позволяет легко концентрироваться, расслабляться и крепко спать, не так просто, как просто захотеть, чтобы это произошло.Есть много факторов, которые влияют на ваше психическое благополучие, и одним из наиболее значимых является группа химических веществ мозга, называемых нейротрансмиттерами , , которые напрямую влияют на то, как вы думаете и чувствуете.
Нейротрансмиттеры — это химические посредники, которые передают сигналы от одной нервной клетки к другой. Есть много разных типов, каждый со своими уникальными функциями. Некоторые нейротрансмиттеры, такие как дофамин , создают ощущение энергии и жизнеспособности , в то время как другие, такие как серотонин , имеют решающее значение для уравновешенного настроения, мира и спокойствия .Уровень и эффективность нейротрансмиттеров напрямую связаны с вашим психическим и эмоциональным благополучием, и дефицит или плохое функционирование одного или нескольких нейротрансмиттеров может вскоре оказать негативное влияние.
Ключевые питательные вещества могут помочь естественным образом поддерживать баланс нейротрансмиттеров и оптимальную функцию. Однако, если вы думаете, что могли бы немного повысить эффективность своей работы, важно сначала определить, в каких областях требуется дополнительная помощь.
Читайте обзор основных нейротрансмиттеров, простой тест, помогающий выявить дисбаланс нейромедиаторов, и краткое изложение основных питательных веществ, необходимых для повышения уровня.
Нейротрансмиттеры — основные типы и функции
Дофаминергические нейротрансмиттеры — «энергия и жизненная сила»:
• Допамин необходим для ходьбы и равновесия, для мотивации, внимания и поведения, направленного на вознаграждение / достижение цели. Дофамин усиливает поведение, от которого вы чувствуете себя хорошо.
• Норадреналин — это нейромедиатор, который готовит мозг и тело к действию.
• Адреналин отвечает за реакцию «бей или беги», возникающую в стрессовых ситуациях.
Серотонинергические нейротрансмиттеры — «расслабление и здоровое душевное состояние»:
• Серотонин влияет на настроение, аппетит и сон. Это нейротрансмиттер спокойствия и терпения, помогает нам справляться со стрессом и разочарованием и помогает ограничить агрессию. У него также есть некоторые когнитивные функции, включая память и обучение.
• Мелатонин имеет решающее значение для регулирования цикла сна-бодрствования. Он вырабатывается шишковидной железой, и его уровень достигает максимума между 12 и 3 часами ночи.
Простой тест для выявления дисбаланса нейромедиаторов
Путь дофамина — энергия и жизнеспособность
• Мне трудно просыпаться утром
• Мне нужен кофеин / энергетические напитки, чтобы начать день
• Я с трудом могу приступить к делу
• Я чувствую усталость перед тем, как приступить к делу
• У меня беспокойный сон
• Меня мало интересуют хобби и занятия
• У меня низкая мотивация к любви и сексу
• Я не работаю ни над какими новыми проектами
• Мне трудно концентрироваться, или мне трудно следовать своему ходу мыслей
• Я чувствую усталость / грусть
• Мне не хватает жизненных сил и динамизм в течение некоторого времени
• Я чувствую себя менее изобретательным и изобретательным, чем раньше
• Мне трудно подбирать слова
Если вы в основном согласны с приведенными выше утверждениями, вероятно, ваш путь дофамина может нуждаться в дополнительной поддержке.
Ключевые питательные вещества, поддерживающие путь дофамина: L-тирозин, фолат (5-MTHF), родиола, сибирский женьшень
Серотониновый путь — «Расслабление и здоровое состояние души»
• Я раздражителен, импульсивен и быстро злюсь
• Я нетерпелив
• Я чувствую себя одновременно подавленным и возбужденным
• Я испытываю тягу к сахару ближе к концу дня
• Я употребляю алкоголь по вечерам, чтобы расслабиться
• Я изо всех сил стараюсь сохранять спокойствие и отойти в сторону
• Мне трудно заснуть
• Я часто бодрствую в 3 часа ночи
• Мои мысли часто волнуются, даже ночью
• Я очень чувствителен к стрессу и шуму
• Мое настроение меняется быстро
• Я чувствую внутреннее нервное напряжение, боль в животе, дискомфорт при пищеварении и / или боль в мышцах
• Я часто чувствую себя «на грани»
• Я склонен к мигрени и чувствителен к свету
Если вы в основном согласны с приведенными выше утверждениями, вероятно, ваш путь серотонина может нуждаться в дополнительной поддержке.
Ключевые питательные вещества, поддерживающие путь серотонина: L-триптофан, магний, фолат (5-MTHF), шафран.
Баланс нейротрансмиттеров — ключ к психическому и эмоциональному благополучию
Поддержание здоровых уровней и функций нейромедиаторов является ключом к психическому и эмоциональному благополучию. Когда нейротрансмиттеры выходят из равновесия, могут возникать различные симптомы, которые со временем могут быть связаны с изнурительными заболеваниями, такими как депрессия и тревога, а в крайних случаях даже с нейродегенеративными заболеваниями, такими как болезнь Паркинсона и Альцгеймера.Если вы считаете, что ваше психическое и эмоциональное благополучие немного ниже номинального и может потребоваться небольшая дополнительная поддержка, вы можете использовать простой тест, чтобы определить область, где вам больше всего нужна помощь, и добавить целевые питательные вещества, чтобы дать вашему мозгу естественную поддержку.
Щелкните изображение, чтобы просмотреть полноцветную версию с высоким разрешением
Авторские права на этот веб-сайт и его содержимое принадлежат Nutri Advanced ©. Все права защищены. См. Наши условия для более подробной информации.
Границы | Обновленная информация о роли серотонина и его взаимодействии с дофамином за вознаграждение
Введение
Среди нейромодуляторов мозга серотонин (5-гидрокситриптамин, 5-HT), вероятно, является наиболее амбивалентным с точки зрения его предполагаемой важности для поведения и уровня понимания. Серотонинергические препараты широко используются при психических расстройствах, злоупотребляют ими в качестве рекреационных наркотиков, и нарушения в серотонинергической системе были определены как важные этиологические факторы многих распространенных расстройств.С другой стороны, 5-HT обычно описывается как «загадочный» в научном контексте (Daw et al., 2002; Luo et al., 2015; Li et al., 2016), что отражает тот факт, что объединяющая функция его физиологическая роль не установлена, и данные часто неубедительны. Хотя участие 5-HT в процессах вознаграждения и отвращения, гедонистическом опыте, настроении и высших когнитивных функциях, таких как сознание или саморефлексия, неоспоримо, его точный вклад является спорным. Эта двусмысленность глубоко укоренилась в истории исследований серотонинергической системы.Из исследований на животных у разных видов давно известно, что ядра шва, являющиеся источником большей части серотонинергической иннервации переднего мозга, являются одними из наиболее мощных областей, вызывающих самостимуляцию, эквивалентную стимуляции медиального пучка переднего мозга или вентральной области покрышки (VTA). ; Miliaressis et al., 1975; Van Der Kooy et al., 1978; Rompre and Miliaressis, 1985). С другой стороны, влиятельные теории функционирования 5-HT позиционируют его как поведенческий ингибитор (Soubrié, 1986), необходимый для облегчения аверсивного процессинга (Tye et al., 1977), поэтому выступая против роли, приписываемой дофамину (DA; Deakin and Graeff, 1991; Daw et al., 2002; Cools et al., 2008a; Dayan and Huys, 2009). Эти частично противоречивые функции могут быть объяснены взаимодействиями между различными типами клеток в шве, которые зависят от серотонина.
Здесь мы опишем роль различных типов клеток в ядрах шва и специфическую анатомию серотонинергической системы для конкретных типов клеток. Сначала мы рассмотрим недавние исследования роли серотонина в поведении человека и животных, связанном с поощрением и отвращением к процессингу.Затем мы связываем эти открытия с новыми результатами, в которых серотонинергические и несеротонинергические сигналы, включая совместное высвобождение других передатчиков, связанных с системой 5-HT, были исследованы с помощью подходов генетического таргетинга. После этого мы сосредотачиваемся на исследованиях самостимуляции в качестве меры вознаграждения у животных, что дает возможность связать полученные данные с поведением человека, включая субъективно испытанное вознаграждение, вызванное лекарствами. В заключение мы резюмируем важность рассмотрения различных клеток и взаимодействия нейромодуляторных систем и совместного высвобождения нейромедиаторов при обсуждении роли нейромодуляторов, таких как 5-HT и DA.
Серотонинергическая система
Плотность 5-HT рецепторов в коре имеет нисходящий ростро-каудальный градиент, что указывает на особенно заметное участие 5-HT в высших когнитивных функциях (Kranz et al., 2010; Celada et al., 2013). Серотонинергические афференты представлены только небольшой группой клеток, расположенных в области шва среднего мозга. Два основных ядра здесь состоят в дорсальном и срединном швах (DRN, MRN), которые включают около 160 000 и 60 000 серотонинергических нейронов у человека, соответственно (Charnay and Léger, 2010).Большая часть серотонинергических входов в передний мозг обеспечивается DRN, на котором мы сосредоточимся здесь. Существуют значительные различия в процентном содержании серотонинергических нейронов в DRN у разных видов: у людей было обнаружено, что 70% нейронов DRN содержат 5-HT (Baker et al., 1991), тогда как у кошек (Léger and Wiklund, 1982) и крыс серотонинергические нейроны не составляют большую часть популяции клеток в DRN. Из оставшихся клеток глутаматергические и ГАМКергические нейроны составляют большинство (Hornung, 2003; Bang and Commons, 2012), а ГАМКергические клетки опосредуют тормозную обратную связь внутри DRN (Liu et al., 2000). Помимо разнообразия типов клеток, совместное высвобождение нейротрансмиттеров все чаще признается функционально значимым (El Mestikawy et al., 2011). Было обнаружено, что нейроны, которые экспрессируют триптофангидроксилазу 2 (Tph3), фермент, ограничивающий скорость синтеза 5-HT, который почти исключительно экспрессируется в серотонинергических нейронах, экспрессируют везикулярный транспортер глутамата типа 3 (VGluT3), который транспортирует глутамат в пресинаптические везикулы в не преимущественно глутаматергические нейроны (Hioki et al., 2010).Высвобождение глутамата из этих 5-HT нейронов неоднократно наблюдалось (Johnson, 1994; Liu et al., 2014; Qi et al., 2014). Совместное высвобождение никоим образом не ограничивается серотонинергической системой, но также признано при дофаминергической нейротрансмиссии (Stuber et al., 2010; Tecuapetla et al., 2010). Это внутреннее переплетение между системами нейротрансмиттеров предполагает, что функциональную значимость нейромодуляторных систем трудно судить при анализе отдельных компонентов физиологической системы, последовательно выделяющих более одного нейромедиатора.
Основная цель понимания нейромодуляторных систем — объединить корреляционные данные, например, из исследований изображений (Macoveanu, 2014), с фармакологическими вмешательствами, и предоставить правдоподобную картину, соединяющую результаты прямых записей исследований специфической активации или повреждений у животных и фармакологических вмешательств. , в конечном итоге согласуется с самоотчетами людей. Методы, влияющие на общий серотонинергический тонус, — это острое истощение триптофана в пище (ATD; Fadda et al., 2000), который снижает 5-HT, нагрузку триптофана, которая предположительно увеличивает 5-HT (Young, 1996), и введение SSRI, которые повышают уровни 5-HT, но могут снизить совместное высвобождение глутамата (Fischer et al., 2015c) . Прямые агонисты рецепторов 5-HT использовались в различных исследованиях со сложными результатами, вероятно, из-за разнообразия рецепторов 5-HT (Hayes and Greenshaw, 2011). Основное ожидание новых оптогенетических методов, которые позволят целенаправленно нацеливать, регистрировать, активировать и ингибировать моноаминергические нейроны и диссоциировать их, например, от ингибирующих ГАМКергических нейронов, заключается в предоставлении доказательств основной физиологической функции 5-HT, которые затем можно было бы использовать. согласовать результаты фармакологических исследований.
Афференты серотонинергической системы
Учитывая важность серотонинергической нейромодуляции для развития тревоги или депрессии (Caspi et al., 2003; Sachs et al., 2015), контроль серотонинергической передачи сигналов очень важен. Только недавно стало возможным специфически отслеживать входы в идентифицированные серотонинергические нейроны, дифференцируя их, например, от афферентных нейронов, которые синапсируют с ГАМКергическими клетками. Это может быть сделано путем специфического нацеливания индикатора на генетически определенные популяции клеток (например, нейроны 5-HT), которые экспрессируют белок, необходимый для того, чтобы индикатор ретроградно перемещался под действием определенного промотора, активного в популяции клеток.При нацеливании, например, на ген промотора транспортера серотонина, этот метод обеспечивает средства для специфической локализации моносинаптических входов в нейроны 5-HT у мышей. Исследования с использованием этого метода показали, что несколько областей мозга моносинаптически проецируются на нейроны DRN 5-HT (Ogawa et al., 2014; Pollak Dorocic et al., 2014), демонстрируя высокий уровень контроля над серотонинергической системой. Вход в определенный серотонинергический DRN, но не в MRN, и определенные дофаминергические нейроны VTA количественно и годологически подобны (Watabe-Uchida et al., 2012; Ogawa et al., 2014), совместимый с сильно дополняющими функциями в обеих системах. К этим входным областям относятся PFC и латеральная габенула (LHb), которые обеспечивают в основном возбуждающий сигнал серотонинергическим, а также ГАМКергическим нейронам в DRN (Pollak Dorocic et al., 2014; Weissbourd et al., 2014; Geddes et al. ., 2016; Zhou et al., 2017). Чистым эффектом такого входа может быть возбуждающее или опосредованное торможение с прямой связью. Кроме того, другой важный путь входа в ядра шва включает в себя в основном ГАМКергическую ретрансляцию входов DRN от LHb через ростромедиальное тегментальное ядро (Jhou et al., 2009; Sego et al., 2014).
Входы от PFC могут модулировать и изменять степень ингибирования или возбуждения в DRN (Geddes et al., 2016). Было обнаружено, что функционально стимуляция нейронов PFC, проецирующихся в DRN, влияет на мотивацию: стимуляция этого пути усиливается, в то время как молчание снижает мотивацию у крыс при выполнении задачи принудительного плавания (Warden et al., 2013). Подкорковые области посылают как возбуждающие, так и тормозные проекции на серотонинергические нейроны, составляя двухтактный регуляторный механизм (Zhou et al., 2017). Предполагается, что LHb опосредует отвращающие сигналы, передаваемые в дофаминергическую и серотонинергическую системы (Matsumoto and Hikosaka, 2007; Hikosaka, 2010). Электрическая стимуляция LHb подавляет запуск клеток DRN (Wang and Aghajanian, 1977), а повреждения LHb повышают уровни DRN 5-HT (Yang et al., 2008) у крыс. Этот восходящий вход в DRN может быть интегрирован ГАМКергическими нейронами, которые контролируют серотонинергическую активность нейронов. Функциональная значимость этого взаимодействия между ГАМКергическими и серотонинергическими нейронами DRN была продемонстрирована для выражения избегания после стресса социального поражения у мышей.После многократного воздействия доминирующих сородичей возбудимость ГАМКергических нейронов в DRN увеличивалась, что приводило к снижению активности 5-HT (Challis et al., 2013). Оптогенетическое подавление нейронов ГАМКергической DRN предотвращало проявление поведенческого избегания, что свидетельствует о причинном влиянии нейронов ГАМКергической DRN на развитие поведения избегания, связанного со стрессом. Кроме того, фармакогенетически специфическая инактивация LHb смягчала последствия стресса социального поражения подобно антидепрессантам даже у мышей, у которых СИОЗС не были эффективны из-за отсутствия синтеза 5-HT (Sachs et al., 2015), что согласуется с идеей, что путь LHb DRN оказывает сильный контроль над передачей сигналов DRN, тогда как 5-HT сам по себе является только частью общей картины. Однако существуют дополнительные дебаты относительно фактической валентности серотонинергических сигналов вдоль оси вознаграждения.
Валентность и серотонин
Влиятельная гипотеза утверждает, что 5-HT контролирует поведенческое торможение в аверсивном контексте (Soubrié, 1986), таком как наказание, денежные потери или упущенное вознаграждение, тем самым приписывая DA и 5-HT противоположные функции (Daw et al., 2002). Напротив, многие исследования показали, что 5-HT влияет на обработку вознаграждений (Kranz et al., 2010), предполагая, что роли обеих систем в значительной степени дополняют друг друга.
В целом, фармакологические манипуляции с серотонинергической нейротрансмиссией у людей предоставили убедительные доказательства участия 5-HT в обработке наказания (Evers et al., 2005; Chamberlain et al., 2006; Crockett et al., 2009; Geurts et al., 2013; Macoveanu et al., 2013). Диетическое снижение серотонинергической активности устраняет замедление реакции, вызванное наказаниями (Crockett et al., 2012), тогда как острое введение СИОЗС, а также генетически обусловленные более высокие уровни 5-HT связаны с усилением замедления реакции после ошибок (Fischer et al., 2015b). Точно так же ATD нарушает ассоциацию прошлых действий с наказаниями, но не с наградами (Tanaka et al., 2009), что позволяет предположить, что уровни 5-HT положительно зависят от способности запоминать и использовать отвращающие события. Однако ATD увеличил способность участников предсказывать отрицательные результаты наблюдаемого выбора (Cools et al., 2008b; Robinson et al., 2012) и увеличил BOLD-ответ на ошибки фМРТ в префронтальной коре (Evers et al., 2005). С другой стороны, предположение о том, что 5-HT опосредует процессинг вознаграждения (Kranz et al., 2010; Luo et al., 2016), также получило значительную эмпирическую поддержку (Rogers et al., 2002; Cools et al., 2005; Del-Ben et al., 2005; Roiser et al., 2006; Tanaka et al., 2007; Seymour et al., 2012), в то время как другие исследования подтверждают как наказание, так и обработку вознаграждения (McCabe et al., 2010; Palminteri et al., 2012; Worbe et al., 2016; Scholl et al., 2017). Таким образом, манипуляции с серотонинергическим тонусом влияют на обработку вознаграждения и наказания, но чистый эффект, ухудшение или облегчение, не совсем согласован во всех исследованиях.
По сравнению с исследованиями на людях, исследования на животных продемонстрировали участие серотонинергической системы в обработке как наказаний, так и поощрений. Используя обратную обучающую задачу с вознаграждением (сок) и наказанием (шум) у мартышек, Rygula et al.(2015) обнаружили, что локальное истощение 5-HT в миндалевидном теле или лобной коре снижает общую чувствительность обратной связи, независимо от валентности. Точно так же исследования на грызунах показали, что общий эффект манипуляций с 5-HT может влиять на чувствительность к наказанию или вознаграждению, в зависимости от метода (SSRI, ATD, истощение 5-HT), дозировки и продолжительности лечения (Bari et al., 2010). Было обнаружено, что СИОЗС и генетически повышенные уровни 5-HT снижают аппетитные оперантные ответы (Sanders et al., 2007), но усиливают беспроигрышное поведение во время обратного обучения у мышей (Brown et al., 2012). Сильное истощение 5-HT снизило инструментальное обучение с подкреплением, основанное на вознаграждении, у крыс (Izquierdo et al., 2012). Сходным образом истощение 5-HT в лобной коре головного мозга мартышек нарушает приобретение реакции на условное подкрепление аппетита, но не угасание (Walker et al., 2009). Подобно исследованиям на людях, общие манипуляции с серотонинергическим тонусом у животных иногда влияют на вознаграждение, а иногда и на наказание. В целом, это предполагает необходимость расширить сферу действия одной нейромодуляторной системы до ее анатомического и нейрохимического контекста.
Вознаграждает ли серотонин или активность DRN?
DRN уже давно считается одной из основных областей мозга, которая способствует самостимуляции, которая сильно усиливает поведение через дофаминергическую систему (Rompre and Miliaressis, 1985). Однако до недавнего времени было неясно, действительно ли этот механизм зависит от клеток, происходящих из DRN, или стимуляция активирует проходящие волокна, а также действительно ли клетки-посредники являются серотонинергическими. Структурная связь между VTA и DRN недавно была описана значительно более точно с помощью новых методов отслеживания конкретных типов клеток.Было обнаружено, что дофаминергические нейроны VTA у мышей получают как самые плотные проекции, так и вторые по численности после выступов полосатого тела из DRN (Watabe-Uchida et al., 2012). Было обнаружено, что эта проекция в основном глутаматергическая, но дополнительно содержит нейроны, совместно высвобождающие 5-HT (McDevitt et al., 2014; Qi et al., 2014). Этот путь управляет самостимуляцией и обусловленным предпочтением места посредством асимметричных синапсов мезостриатным нейронам VTA DA (Qi et al., 2014). Как блокада полосатых рецепторов D1, так и блокада глутаматергических сигналов в VTA устраняют эти эффекты.Кроме того, ингибирующие ГАМКергические проекции от VTA и полосатого тела регулируют активность 5-HT, образуя петлю обратной связи, которая переплетает системы DA и 5-HT в цепи вознаграждения (Pollak Dorocic et al., 2014), хотя исследования по отслеживанию показывают, что 5-HT находится в более сильном положении для контроля активности DA, чем наоборот (Ogawa et al., 2014).
Исследования регистрации одиночных нейронов показали, что нейроны DRN, которые предположительно содержат 5-HT, обрабатывают вознаграждение. Было обнаружено, что у крыс и обезьян эти нейроны DRN отражают величину доставленного жидкого вознаграждения, а также общую вероятность вознаграждения (Nakamura et al., 2008; Бромберг-Мартин и др., 2010; Инаба и др., 2013). Используя кальциевую визуализацию и фотометрию волокон, метод для наблюдения активности в специфически нацеленных популяциях нейронов, недавно было показано, что нейроны DRN 5-HT, положительные по переносчику серотонина (SERT + ), демонстрируют сильную модуляцию активности, связанную с вознаграждением, но не связанную с отвращением поведение мышей (Li et al., 2016). Эти нейроны увеличивали активность во время потребления первичных подкреплений (сахара, секса), и пока животные ждали доставки награды.Это подтверждает серию предыдущих экспериментов, в которых предполагалось, что 5-HT опосредует контроль над импульсами, ожидая будущего вознаграждения (Miyazaki KW et al., 2012; Miyazaki K. et al., 2012; Miyazaki et al., 2014), и говорит о том, что участие 5-HT нейронов SERT + в первичной обработке вознаграждения. Интересно, что активность предполагаемых (Inaba et al., 2013; Hayashi et al., 2015) и оптогенетически определенных 5-HT нейронов отображает сигналы, связанные с ценностями, в разных временных масштабах (Cohen et al., 2015).У мышей, удерживающих подголовник, Cohen et al. (2015) обнаружили, что серотонинергические нейроны очень быстро реагируют на награды и наказания, но при этом сохраняется постоянная активность, которая, возможно, отражает «полезность» (Luo et al., 2016) текущей среды или мотивационного состояния в течение периодов до 10 секунд. (Cohen et al., 2015). Эти длительные изменения отражаются в довольно низких изменениях частоты возбуждения в диапазоне 1-2 спайков в секунду, которые, тем не менее, могут оказывать значительное влияние на серотонинергическую иннервацию целевых структур, особенно с учетом низкой исходной частоты возбуждения, наблюдаемой в большинстве 5-HT нейроны.
Оптогенетическая стимуляция позволила по-новому взглянуть на функциональные эффекты активации определенных нейронов DRN. Лю и др. (2014) экспрессировали светочувствительный ионный канал в нейронах DRN, нацеленный через область энхансера, связанную с геном Pet-1, который избирательно (но не исключительно) экспрессируется в серотонинергических нейронах (Scott et al., 2005). Стимуляция нейронов Pet-1 + оказалась очень полезной, вызывая условное предпочтение места в течение периода стимуляции, инструментальное обучение и благоприятную конкуренцию с естественным подкреплением (Liu et al., 2014). Эти эффекты в основном зависели от совместного высвобождения глутамата и были уменьшены, но не отсутствовали у мышей, лишенных VGluT3. Соответственно, прямое нацеливание на нейроны VGluT3 + , проецирующиеся от DRN к VTA, из которых только некоторые содержат 5-HT, вызывало сильную самостимуляцию (Qi et al., 2014), что указывает на то, что нейроны DRN могут вызывать импульсную стрельбу в VTA DA. нейроны, которые управляют поведенческим подкреплением (Grace et al., 2007). Другое исследование показало, что нейроны орбитофронтальной коры, активность которых отражает предполагаемые естественные подкрепления, также кодируют предполагаемую интенсивность стимуляции DRN Pet-1 + (Zhou et al., 2015), что указывает на сходство между естественными усилителями и искусственной стимуляцией DRN. Однако очень похожий протокол стимуляции, снова нацеленный на нейроны DRN Pet-1 + , не воспроизводил положительные эффекты, о которых сообщалось ранее (McDevitt et al., 2014).
Другой подход к нацеливанию на нейроны 5-HT в DRN для оптогенетической активации — это генетическая маркировка SERT. Предполагается, что нацеливание на SERT снижает частичное совпадение с глутаматергическими популяциями (Luo et al., 2015), но требуется дополнительная эмпирическая проверка этого предположения.В качестве предостережения, нацеливание на 5-HT нейроны посредством SERT требует гетерозиготного нокаута, эффективно деактивирующего один аллель SERT, который сам по себе изменяет серотонинергическую активность (Mathews et al., 2004). В этом направлении исследований не удалось воспроизвести положительные эффекты стимуляции нейронов DRN 5-HT. Не было обнаружено, что стимуляция вызывает устойчивое предпочтение места или усиливает поведение (Fonseca et al., 2015; Correia et al., 2017). Кроме того, когда 5-HT нейроны были нацелены через регуляторные элементы ограничивающего скорость фермента в синтезе 5-HT, Tph3, не наблюдалось никаких непосредственно положительных эффектов стимуляции (Miyazaki et al., 2014). Недавно Correia et al. (2017) обнаружили, что кратковременная активация нейронов DRN SERT + снова приводит к замедлению поведения в отсутствие положительных эффектов, что, однако, не мешает мотивированному поведению.
Еще одна ключевая особенность, которая связывает обработку вознаграждения с обучением и поведенческой адаптацией, — это вычисление обучающих сигналов в форме ошибок предсказания вознаграждения или наказания (PE), что было признано центральной функцией системы DA. Недавно было обнаружено, что различные субпопуляции дофаминергических нейронов со специфическими областями проекции по-разному реагируют на вознаграждение, новизну и отвращение.Проекционные нейроны в вентральном полосатом теле отражают вознаграждение, но, по-видимому, нечувствительны к аверсивным событиям и новизне (Eshel et al., 2016; Menegas et al., 2017), что дополнительно может модулироваться контекстом вознаграждения (Matsumoto et al., 2016). Напротив, другие нейроны VTA (Matsumoto and Hikosaka, 2009), а также определенные дофаминергические нейроны (Cohen et al., 2012) отражают отталкивающие стимулы и новизну, но они, по-видимому, проецируются на более каудальные области полосатого тела (Menegas et al. ., 2017). В некоторых недавних исследованиях изучается кодирование РЕ вознаграждения в определенных серотонинергических нейронах.Matias et al. (2017) сообщили, что нейроны 5-HT SERT + в DRN на уровне популяции отражают PE с положительным вознаграждением, что согласуется с несколькими другими исследованиями (Nakamura et al., 2008; Inaba et al., 2013; Cohen et al., 2015; Hayashi et al., 2015) и очень похожи на нейроны DA в VTA. Однако, в то время как DA-нейроны, кодирующие PE, снижали частоту срабатывания, когда ожидаемое вознаграждение было пропущено или заменено вероятными отвращающими событиями (воздушный поток, направленный в глаз), составляющий подписанный PE-сигнал, нейроны 5-HT отражали в основном неподписанные PE или неожиданность. .Интересно, что нейроны 5-HT медленнее приспосабливались к изменениям ожидания, что привело к изменению предполагаемой относительной доступности 5-HT и DA во время изучения ожиданий вознаграждения. Это приводит к ситуации, в которой, например, в задачах обратного обучения переключение с ранее хорошего стимула на теперь плохое сопровождается ранним снижением активности DA, но более продолжительным сигналом 5-HT, который только позже адаптируется к новый ожидаемый уровень вознаграждения. Это может объяснить, почему 5-HT во многих случаях приписывают DA в основном враждебную роль (Daw et al., 2002). Остается открытым вопрос, представляют ли ГАМКергические нейроны в DRN ожидаемое значение, подобное роли ГАМКергических нейронов в VTA в расчете PE дофаминергического вознаграждения (Cohen et al., 2012; Eshel et al., 2015).
Интересным наблюдением является то, что оптогенетически определенные серотонинергические нейроны, как было обнаружено, раньше, хотя и менее энергично, реагировали на предсказывающие сигналы вознаграждения, чем нейроны DA (Cohen et al., 2015), но позже, чем некоторые корковые сигналы, связанные с вознаграждением (Ullsperger et al., 2014). Это может указывать на то, что деятельность, связанная с вознаграждением DRN, представляет собой модулирующий контроль высокого уровня над системой вознаграждения мозга, в зависимости от входных данных от вышележащих областей коры, участвующих в обработке вознаграждения.
В целом, похоже, что серотонинергические нейроны кодируют сигналы вознаграждения, согласованные у разных видов, однако их оптогенетическая активация вознаграждается только тогда, когда либо глутамат совместно высвобождается, либо глутаматергические нейроны DRN нацелены. Эти глутаматергические клетки сильно проецируются на VTA и способны задействовать дофаминергические схемы вознаграждения.В исследованиях на животных, вызывающие отвращение события (Li et al., 2016) не всегда кодируются серотонинергическими нейронами. Это можно объяснить тем, что в большинстве этих исследований животные были привязаны к голове (Cohen, 2015; Matias et al., 2017). Само по себе ограничение может быть фактором стресса, мешающим физиологическим паттернам нейрональной активности нейронного модулятора, который, как считается, участвует в обработке вознаграждения и настроении.
Роль 5-HT в вызванной лекарствами эйфории и контроле за поведением, связанным с получением вознаграждения
Низкий уровень 5-HT является известным диатезом, приводящим к развитию тревожных расстройств, депрессии (Jacobsen et al., 2012; Sachs et al., 2015), но также и наркомании (Ducci, Goldman, 2012). Кроме того, большинство препаратов, вызывающих привыкание, либо вызывают повышенное высвобождение 5-HT, либо непосредственно агонируют 5-HT рецепторы. Два основных компонента вознаграждения можно определить как «симпатия», отражающая приятное субъективное состояние, и «желание», отражающее подкрепляющие свойства ситуации или вещества (Berridge et al., 2009). Оценка симпатии на животных моделях в основном опирается на исследования выражения лица, например, на мышах, где было продемонстрировано, что DA, хотя и усиливает поведение, не вызывает симпатии (Wyvell and Berridge, 2000; Leyton et al., 2002; Берридж и Робинсон, 2003). С другой стороны, субъективные эффекты лекарств, о которых сообщают у людей, могут быть информативными для основных систем нейротрансмиттеров и того, как они опосредуют эффекты.
Группа высвобождающих моноаминов, которые увеличивают DA, 5-HT и норэпинефрин (NE), а также их наиболее часто употребляемые варианты, такие как кокаин, амфетамин и метилендиоксиметамфетамин (МДМА или экстази), после каннабиса являются незаконными наркотиками, которые наиболее широко используются. Вопреки первоначальным предположениям, способность высвобождать NE, по-видимому, существенно не влияет на способность этих веществ вызывать привыкание (Banks et al., 2014), но было обнаружено, что относительный потенциал высвобождения 5-HT по сравнению с DA влияет как на эйфорические, так и на вызывающие привыкание свойства препарата. Интересно, что способность лекарств к высвобождению 5-HT, даже когда эффекты на высвобождение DA и NE сравнимы, отрицательно коррелирует с его эффективностью как стимулятора поведения (Wee et al., 2005). Это было продемонстрировано с использованием различных производных амфетамина на обезьянах со сравнимыми NE- и DA-, но разными свойствами высвобождения 5-HT. Кроме того, отдельные обезьяны с более выраженным высвобождением 5-HT, индуцированным МДМА, постоянно самостоятельно вводили препарат меньше, чем люди с более низким высвобождением.Добавление агента, высвобождающего серотонин, фенфлурамина к амфетамину, принимаемому самостоятельно, также уменьшало самостоятельное введение (Wee and Woolverton, 2006). Соответственно, разрушение серотонинергической системы с использованием селективного нейротоксина 5,7-DHT увеличивало скорость самостоятельного введения МДМА и скорость его усвоения у крыс (Bradbury et al., 2013). Это говорит о том, что 5-HT уравновешивает поведенческие эффекты DA.
Еще один способ оценить поведенческий контроль над поведением с вознаграждением в лабораторных условиях — это объединить внутричерепную самостимуляцию (ICSS) областей вознаграждения (часто среднего пучка переднего мозга) с приемом лекарств.В этой ситуации было показано, что высвобождающие DA агенты усиливают самостимуляцию, что интерпретируется как контекстно-зависимое облегчение аддиктивного поведения. Интересно, что селективные высвобождающие 5-HT ингибируют ICSS (Olds and Yuwiler, 1992), и, более того, относительная специфичность высвобождения 5-HT по сравнению с DA отрицательно зависит от содействия ICSS (Bauer et al., 2013). Однако это общее ингибирующее влияние 5-HT на ICSS упрощено, и другие исследования показывают, что общий эффект 5-HT на стимуляцию мозга зависит, среди других факторов, от локуса применения 5-HT (Kranz et al., 2010). Хотя аддиктивное поведение развивается в течение более длительного периода времени и включает сложные адаптации в серотонинергической системе (Müller and Homberg, 2014), есть данные исследований на животных, свидетельствующие о том, что целостность серотонинергической системы и более высокое высвобождение 5-HT снижает самостоятельное введение лекарств. .
Исследования на людях, сочетающие фармакологические манипуляции с системой 5-HT и методы визуализации, не дали однозначной картины (Macoveanu, 2014), отчасти из-за сложности улавливания сигналов ствола мозга, связанных с активностью DRN или MRN.Tanaka et al. (2004) обнаружили, что повышенная активность перекрывается с DRN, когда участникам приходилось терпеть краткосрочные потери, чтобы получить долгосрочное вознаграждение, аналогично эффектам, наблюдаемым в спинном полосатом теле. Этот полосатый сигнал модулировался манипуляциями с уровнями 5-HT у людей, и ковариация между дорсальным полосатым телом и долгосрочным вознаграждением положительно зависела от уровней 5-HT (Tanaka et al., 2007). Кроме того, было обнаружено, что ATD у людей снижает влияние предыдущих наград на текущий выбор и увеличивает тенденцию повторять предыдущие выборы в динамически изменяющейся задаче обучения с подкреплением (Seymour et al., 2012).
Эти результаты относятся к жестокому поведению человека, а также, по-видимому, анализируют полезные свойства наркотика, сопоставляя его желание с DA и предположительно симпатию к 5-HT аддитивным образом. Эпидемиологические данные показывают, что уровень злоупотребления МДМА значительно ниже по сравнению с высвобождающими моноамины препаратами с меньшим серотонинергическим действием, такими как амфетамины (Degenhardt et al., 2010). С другой стороны, даже по сравнению с высокими дозами амфетамина, МДМА субъективно воспринимается как более приятный, вызывающий положительное настроение и вызывающий эйфоризм (Camí et al., 2000; Тансер и Йохансон, 2003; Carhart-Harris et al., 2015). Более селективные высвобождающие 5-HT, которые сохраняют DA, на удивление, не являются ни усиливающими (Woods and Tessel, 1974), ни воспринимаются людьми как приятные. Фактически, было обнаружено, что селективный высвобождающий 5-HT м-хлорфенилпиперазин (mCPP) снижает позитивное настроение и эйфорию (Tancer and Johanson, 2003), а острое внутривенное введение СИОЗС у здоровых участников повышает самооценку печали и некомпетентности (Fischer et al., 2015a).Это говорит о том, что 5-HT в физиологических условиях уравновешивает усиливающие эффекты DA, хотя сам по себе не является ни подкрепляющим, ни вознаграждающим, но может иметь важное значение для подавления усиленного поведения, чтобы способствовать поведенческой гибкости (Branchi, 2011; Fischer et al., 2015b; Matias et al. др., 2017).
Короче говоря, в соответствии с субъективными эффектами лекарств, положительное вознаграждение может отражаться комбинацией DA и 5-HT, тогда как наказание может отражаться 5-HT и отсутствием или уменьшением DA (Cohen et al., 2015).
Методологические соображения
Мы приложили усилия в этот обзор, чтобы включить в него, в частности, результаты исследований, в которых используются новейшие современные методы, такие как оптогенетика. Они обещали разрешить многие противоречия относительно системы 5-HT путем однозначной идентификации и вмешательства в определенные нейронные популяции, для которых до сих пор идентификация была относительно неспецифической, используя в основном либо паттерны возбуждения, либо рецептор-зависимые изменения активности. Однако даже эти специфические методы дают противоречивые результаты.Например, несомненно, прямая стимуляция DRN является полезной, как известно из исследований самостимуляции (Miliaressis et al., 1975; Van Der Kooy et al., 1978; Rompre and Miliaressis, 1985), и подтверждается оптогенетической стимуляцией либо в основном глутаматергических, не -серотонинергические нейроны с выходом DRN (McDevitt et al., 2014) или нейроны, совместно высвобождающие 5-HT и глутамат (Liu et al., 2014; Qi et al., 2014). С другой стороны, более специфичный для 5-HT профиль стимуляции, нацеленный на нейроны SERT + или Tph3 + , не воспроизводит положительных эффектов (Miyazaki et al., 2014; Fonseca et al., 2015; Correia et al., 2017), возможно, из-за отсутствия глутаматергической передачи сигналов, а острое введение СИОЗС редко считается полезным (Fischer et al., 2015a). Интерпретация отсутствия эффектов представляется сложной, если такая стимуляция отличается от физиологической активности. В настоящее время неизвестно, являются ли физиологические входы из определенных областей в DRN асимметричным синапсом в чисто серотонинергические, глутаматергические, ко-высвобождающие или другие, например, ГАМКергические нейроны.Таким образом, оптогенетическая стимуляция может в некоторых случаях быть сверхспецифичной в смысле вызова нефизиологического сигнала, который может не вызывать те же поведенческие эффекты, что и обычно происходящая активация серотонинергических путей путем стимуляции нейронов, которые обычно срабатывают независимо.
С другой стороны, хорошо известно, что группа ядер шва участвует в различных физиологических функциях в зависимости от их топографии (Hale and Lowry, 2011). Более того, были продемонстрированы различные профили афферентных проекций.В то время как PFC и LHb проецируются с двух сторон на DRN, другие области, такие как миндалина и гипоталамус, асимметрично синапсы с ипсилатеральными частями (Zhou et al., 2017). Недавно было обнаружено, что оптогенетическая стимуляция проекционных нейронов SERT + DRN к ядру ложа концевой полоски вызывает страх и тревогу (Marcinkiewcz et al., 2016), тогда как такая же стимуляция нейронов SERT + в DRN сам по себе этот эффект не проявляет (Correia et al., 2017). Это поднимает вопрос, может ли: (а) изолированная стимуляция отдельных путей может быть чрезмерно специфичной; или (б) активация популяций нейронов в пределах области все еще может быть недостаточно специфичной.
Кроме того, крайне важно учитывать возможность совместного высвобождения других нейротрансмиттеров из моноаминергических нейронов, что может приводить к очень разным эффектам при сравнении исследований лекарств, например, с использованием агонистов или высвобождающих агентов, которые обходят совместное высвобождение, с исследованиями стимуляции, которые вызывают совместное высвобождение в зависимости от точного метода, используемого для нацеливания на определенные нейроны (Hu, 2016). Рассмотрение таких несоответствий, связанных с совместным высвобождением, может объяснить загадочные эффекты лекарств, которые часто не согласуются с физиологическими гипотезами (Fischer et al., 2015c).
Заключение
Афферентные и эфферентные проекции, годологические свойства, временной ход индивидуальной нейронной активности, преодолевающий короткую латентность и более длительные модуляции активности, — все это идеальное положение серотонинергической системы для извлечения важной с точки зрения мотивации информации и привлечения внимания для направления целенаправленных действий к вознаграждению. Исследования на людях и животных, которые манипулировали уровнями 5-HT, убедительно подтверждают роль серотонина в аффективном процессинге, но направление ассоциации и специфичность для отвращающих или положительных событий остается спорным.Оптогенетические исследования на грызунах показывают, что DA и 5-HT совместно управляют обучением путем положительного кодирования сигналов PE вознаграждения, тогда как отсутствие DA и присутствие 5-HT связано с пропуском вознаграждения и, возможно, с сигналами PE наказания. Кроме того, DRN контролирует высвобождение 5-HT во многие области проекции и может задействовать дофаминергические схемы вознаграждения через глутамат. Было обнаружено, что активация чисто серотонинергических клеток в основном не приносит пользы или является чисто тормозящей. Взятые вместе, это можно интерпретировать так, что манипуляции, увеличивающие сигналы 5-HT без последовательного увеличения DA, имитируют аверсивные события.С другой стороны, прямая стимуляция DRN, специфическая стимуляция высвобождающих глутамат и совместного высвобождения клеток DRN, вызывает положительные эффекты, сравнимые с прямой стимуляцией VTA (McDevitt et al., 2014). Таким образом, оказывается, что определенные популяции нейронов DRN контролируют связанное с DA поведение вознаграждения посредством высвобождения и совместного высвобождения глутамата. Таким образом, вознаграждение, по всей видимости, опосредовано глутаматергическим возбуждением нейронов DA, по крайней мере частично, за счет ввода DRN (Liu et al., 2014; McDevitt et al., 2014; Qi et al., 2014) и параллельный выпуск 5-HT. В соответствии с этим субъективные самоотчеты людей предполагают, что единичное увеличение высвобождения 5-HT или DA не воспринимается как приятное, но совместное увеличение очень приятно. Интересная дополнительная возможность заключается в том, что нейроны 5-HT могут, кроме того, со временем интегрировать эффекты DA в более длительные аффективные сигналы, передаваемые тоническим способом (Cohen et al., 2015). Это совместимо с идеей, что 5-HT кодирует полезность (Луо и др., 2016), и может сигнализировать о мотивации либо поддерживать, либо менять текущее поведение, например, проявляется ролью 5-HT в обеспечении терпения для будущих вознаграждений (Miyazaki et al., 2014). В сочетании с открытием того факта, что уровни 5-HT за счет немедленного высвобождения или предварительной обработки бивалентно модулируют активность веществ, вызывающих сильную зависимость, таких как амфетамины или кокаин (Wee et al., 2005; Cunningham and Anastasio, 2014), возможно, что он функционально управляет системы вознаграждения в мозгу через параллельную быструю активацию и медленное длительное торможение.Таким образом, 5-HT дополнительно, по-видимому, контролирует побуждающие к мотивации эффекты DA, о чем свидетельствует наркозависимость.
Высокоспецифические методы стимуляции нейромодуляторных систем раскрывают сложность и взаимосвязь между нейромодуляторными системами на нескольких уровнях, но не дают простых ответов. По мере сбора большего количества данных выясняется, что оценка эффекта одной только нейромодуляторной системы нефизиологична. Тем не менее, сходясь между фармакологическими эффектами у людей и оптогенетической стимуляцией у животных, DA и 5-HT вместе обеспечивают сигналы, которые взаимозависимо достаточны для управления поведенческой адаптацией, связанной с вознаграждением, и вызывают субъективное вознаграждение.Эта сложность имеет прямые последствия для интерпретации фармакологических, генетических и корреляционных исследований на людях и указывает на то, что DA и 5-HT не имеют противоположных функций (Daw et al., 2002), а скорее могут совместно обеспечивать комбинированный сигнал вознаграждения. , а его разобщенность может закодировать наказание.
Авторские взносы
AGF написал рукопись, AGF и MU обсудили, исправили и разработали рукопись.
Финансирование
AGF финансируется CBBS ScienceCampus, финансируемым Ассоциацией Лейбница (SAS-2015-LIN-LWC).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим Герхарда Йохама за комментарии к рукописи.
Сноски
Список литературы
Бейкер, К.Г., Холлидей, Г.М., Хорнунг, Дж.-П., Геффен, Л. Б., Коттон, Р. Г. Х., и Тёрк, И. (1991). Распределение, морфология и количество нейронов, синтезирующих моноамин и вещество P, в ядре дорсального шва человека. Неврология 42, 757–775. DOI: 10.1016 / 0306-4522 (91)
-nPubMed Аннотация | CrossRef Полный текст | Google Scholar
Банг, С. Дж., И Коммонс, К. Г. (2012). ГАМКергические проекции переднего мозга из ядра дорсального шва, идентифицированные с помощью мышей с нокаутом GAD67-GFP. Дж.Комп. Neurol. 520, 4157–4167. DOI: 10.1002 / cne.23146
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бэнкс, М. Л., Бауэр, К. Т., Блаф, Б. Е., Ротман, Р. Б., Партилла, Дж. С., Бауман, М. Х. и др. (2014). Связанные со злоупотреблением эффекты двойных высвобождающих дофамин / серотонин с различной эффективностью высвобождения норадреналина у самцов крыс и макак-резусов. Exp. Clin. Psychopharmacol. 22, 274–284. DOI: 10.1037 / a0036595
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бари, А., Theobald, D.E., Caprioli, D., Mar, A.C., Aidoo-Micah, A., Dalley, J. W., et al. (2010). Серотонин модулирует чувствительность к вознаграждению и отрицательной обратной связи в задаче обучения с вероятностным обращением у крыс. Нейропсихофармакология 35, 1290–1301. DOI: 10.1038 / npp.2009.233
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бауэр, К. Т., Бэнкс, М. Л., Блаф, Б. Э. и Негус, С. С. (2013). Использование внутричерепной самостимуляции для оценки связанных со злоупотреблением и ограничивающих злоупотребление эффектами высвобождающих моноаминов у крыс. руб. J. Pharmacol. 168, 850–862. DOI: 10.1111 / j.1476-5381.2012.02214.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Берридж, К. К., Робинсон, Т. Э. и Олдридж, Дж. У. (2009). Разделение компонентов вознаграждения: «симпатия», «желание» и обучение. Curr. Opin. Pharmacol. 9, 65–73. DOI: 10.1016 / j.coph.2008.12.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брэдбери, С., Берд, Дж., Колусси-Мас, Дж., Мюллер, М., Рикаурте, Г., Шенк, С. (2013). Приобретение самостоятельного введения МДМА: фармакокинетические факторы и индуцированное МДМА высвобождение серотонина. Наркоман. Биол. 19, 874–884. DOI: 10.1111 / adb.12069
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бранчи, И. (2011). Двойной меч нервной пластичности: повышение уровня серотонина ведет как к большей уязвимости к депрессии, так и к повышению способности к выздоровлению. Психонейроэндокринология 36, 339–351.DOI: 10.1016 / j.psyneuen.2010.08.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бромберг-Мартин, Э. С., Хикосака, О., Накамура, К. (2010). Кодирование значения вознаграждения за задание в ядре спинного шва. J. Neurosci. 30, 6262–6272. DOI: 10.1523 / JNEUROSCI.0015-10.2010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Браун, Х. Д., Амодео, Д. А., Суини, Дж. А., и Рагоззино, М. Э. (2012). Селективный ингибитор обратного захвата серотонина, эсциталопрам, усиливает ингибирование доминантного ответа и обучения пространственному обращению. J. Psychopharmacol. 26, 1443–1455. DOI: 10.1177 / 0269881111430749
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ками, Дж., Фарре, М., Мас, М., Розет, П. Н., Пудевида, С., Мас, А. и др. (2000). Фармакология человека 3,4-Метилендиоксиметамфетамина («Экстази»): психомоторные характеристики и субъективные эффекты. J. Clin. Psychopharmacol. 20, 455–466. DOI: 10.1097 / 00004714-200008000-00010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кархарт-Харрис, Р.Л., Мерфи, К., Пиявка, Р., Эрритцо, Д., Уолл, М. Б., Фергюсон, Б. и др. (2015). Влияние острого введения 3,4-метилендиоксиметамфетамина на спонтанную функцию мозга у здоровых добровольцев измерялось с помощью маркировки спина артерий и функциональной связности в состоянии покоя в зависимости от уровня кислорода в крови. Biol. Психиатрия 78, 554–562. DOI: 10.1016 / j.biopsych.2013.12.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каспи, А., Сагден, К., Моффит, Т.Э., Тейлор А., Крейг И. В., Харрингтон Х. и др. (2003). Влияние жизненного стресса на депрессию: сдерживание полиморфизмом в гене 5-HTT. Наука 301, 386–389. DOI: 10.1126 / science.1083968
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Challis, C., Boulden, J., Veerakumar, A., Espallergues, J., Vassoler, F.M., Pierce, R.C., et al. (2013). ГАМКергические нейроны Raphe опосредуют приобретение избегания после социального поражения. J. Neurosci. 33, 13978–13988. DOI: 10.1523 / JNEUROSCI.2383-13.2013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чемберлен, С. Р., Мюллер, У., Блэквелл, А. Д., Кларк, Л., Роббинс, Т. В., и Саакян, Б. Дж. (2006). Нейрохимическая модуляция торможения ответа и вероятностного обучения у людей. Наука 311, 861–863. DOI: 10.1126 / science.1121218
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коэн, Дж. Й., Хеслер, С., Вонг, Л., Лоуэлл, Б. Б., и Учида, Н. (2012). Специфические для нейронного типа сигналы вознаграждения и наказания в вентральной тегментальной области. Природа 482, 85–88. DOI: 10.1038 / природа10754
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коулс, Р., Блэквелл, А., Кларк, Л., Мензис, Л., Кокс, С., и Роббинс, Т. У. (2005). Истощение триптофана нарушает мотивационное руководство целенаправленным поведением как функцию импульсивности. Нейропсихофармакология 30, 1362–1373.DOI: 10.1038 / sj.npp.1300704
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коулс Р., Робертс А. К. и Роббинс Т. В. (2008a). Серотонинергическая регуляция процессов эмоционального и поведенческого контроля. Trends Cogn. Sci. 12, 31–40. DOI: 10.1016 / j.tics.2007.10.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коулс Р., Робинсон О. Дж. И Саакян Б. (2008b). Острое истощение триптофана у здоровых добровольцев улучшает предсказание наказания, но не влияет на предсказание вознаграждения. Нейропсихофармакология 33, 2291–2299. DOI: 10.1038 / sj.npp.1301598
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коррейя П. А., Лоттем Э., Банерджи Д., Мачадо А. С., Кэри М. Р. и Майнен З. Ф. (2017). Временное ингибирование и долгосрочное облегчение передвижения путем фазовой оптогенетической активации серотониновых нейронов. Элиф 6: e20975. DOI: 10.7554 / eLife.20975
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Крокетт, М.Дж., Кларк, Л., Апергис-Схаут, А. М., Морейн-Замир, С., и Роббинс, Т. В. (2012). Серотонин модулирует эффекты павловских аверсивных предсказаний на силу ответа. Нейропсихофармакология 37, 2244–2252. DOI: 10.1038 / npp.2012.75
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Крокетт, М. Дж., Кларк, Л., и Роббинс, Т. У. (2009). Примирение роли серотонина в поведенческом торможении и отвращении: острое истощение триптофана отменяет индуцированное наказанием ингибирование у людей. J. Neurosci. 29, 11993–11999. DOI: 10.1523 / JNEUROSCI.2513-09.2009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дел-Бен, К. М., Дикин, Дж. Ф. У., Маккай, С., Делвай, Н. А., Уильямс, С. Р., Эллиотт, Р. и др. (2005). Влияние предварительной обработки циталопрамом на нейронные реакции на нейропсихологические задачи у нормальных добровольцев: исследование фМРТ. Нейропсихофармакология 30, 1724–1734. DOI: 10.1038 / sj.npp.1300728
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эль Местикави, С., Валлен-Маккензи, Э., Фортин, Г. М., Декарри, Л., и Трюдо, Л.-Э. (2011). От совместного высвобождения глутамата до везикулярной синергии: везикулярные переносчики глутамата. Нат. Rev. Neurosci. 12, 204–216. DOI: 10.1038 / nrn2969
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эшел, Н., Буквич, М., Рао, В., Хеммелдер, В., Тиан, Дж., И Учида, Н. (2015). Арифметические и локальные схемы, лежащие в основе ошибок предсказания дофамина. Природа 525, 243–246.DOI: 10.1038 / природа14855
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эшел, Н., Тиан, Дж., Буквич, М., и Учида, Н. (2016). Дофаминовые нейроны имеют общую функцию ответа на ошибку предсказания вознаграждения. Нат. Neurosci. 19, 479–486. DOI: 10.1038 / NN.4239
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эверс, Э. А. Т., Коулс, Р., Кларк, Л., ван дер Вин, Ф. М., Джоллес, Дж., Саакян, Б. Дж. И др. (2005). Серотонинергическая модуляция префронтальной коры во время отрицательной обратной связи в вероятностном обратном обучении. Нейропсихофармакология 30, 1138–1147. DOI: 10.1038 / sj.npp.1300663
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фадда, Ф., Кокко, С., и Станкампиано, Р. (2000). Физиологический метод избирательного снижения выброса серотонина в головном мозге. Brain Res. Protoc. 5, 219–222. DOI: 10,1016 / s1385-299x (00) 00016-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фишер, А.Г., Эндрасс, Т., Гебель, И., Рейтер, М., Montag, C., Kubisch, C., et al. (2015a). Интерактивные эффекты циталопрама и генотипа переносчика серотонина на нейронные корреляты ингибирования ответа и ориентации внимания. Neuroimage 116, 59–67. DOI: 10.1016 / j.neuroimage.2015.04.064
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фишер А.Г., Эндрасс Т., Рейтер М., Кубиш К. и Ульспергер М. (2015b). Ингибиторы обратного захвата серотонина и генотип переносчика серотонина модулируют функции мониторинга производительности, но не их электрофизиологические корреляты. J. Neurosci. 35, 8181–8190. DOI: 10.1523 / JNEUROSCI.5124-14.2015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фишер А. Г., Джохам Г. и Ульспергер М. (2015c). Двойные серотонинергические сигналы: ключ к пониманию парадоксальных эффектов? Trends Cogn. Sci. 19, 21–26. DOI: 10.1016 / j.tics.2014.11.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фонсека, М.С., Мураками, М., и Майнен, З.Ф. (2015).Активация серотонинергических нейронов дорсального шва способствует ожиданию, но не подкрепляет. Curr. Биол. 25, 306–315. DOI: 10.1016 / j.cub.2014.12.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Геддес, С. Д., Ассадзада, С., Лемелин, Д., Соколовски, А., Бержерон, Р., Хадж-Дахман, С., и др. (2016). Целенаправленная модуляция входов нисходящей префронтальной коры в ядро дорсального шва каннабиноидами. Proc. Natl. Акад. Sci. U S A 113, 5429–5434.DOI: 10.1073 / pnas.1522754113
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Geurts, D. E. M., Huys, Q. J. M., den Ouden, H. E. M., and Cools, R. (2013). Серотонин и аверсивный павловский контроль инструментального поведения человека. J. Neurosci. 33, 18932–18939. DOI: 10.1523 / JNEUROSCI.2749-13.2013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Грейс, А. А., Флореско, С. Б., Гото, Ю., и Лодж, Д. Дж. (2007). Регулирование возбуждения дофаминергических нейронов и контроль целенаправленного поведения. Trends Neurosci. 30, 220–227. DOI: 10.1016 / j.tins.2007.03.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хейл, М. У., и Лоури, К. А. (2011). Функциональная топография серотонинергических систем среднего мозга и моста: значение для синаптической регуляции серотонинергических цепей. Психофармакология 213, 243–264. DOI: 10.1007 / s00213-010-2089-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хаяси, К., Накао, К., Накамура, К. (2015). Аппетитивное и отталкивающее кодирование информации в ядре спинного шва приматов. J. Neurosci. 35, 6195–6208. DOI: 10.1523 / JNEUROSCI.2860-14.2015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хиоки, Х., Накамура, Х., Ма, Й.-Ф., Конно, М., Хаякава, Т., Накамура, К.С. и др. (2010). Несеротонергические проекционные нейроны, экспрессирующие везикулярный транспортер глутамата 3, составляют субрегион в ядрах шва среднего мозга крысы. J. Comp. Neurol. 518, 668–686. DOI: 10.1002 / cne.22237
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Инаба, К., Мидзухики, Т., Сетогава, Т., Тода, К., Ричмонд, Б. Дж., И Шидара, М. (2013). Нейроны в начале кода ядра шва спинного шва обезьяны и прогресс пошагового расписания, ожидание вознаграждения и сумма результата вознаграждения в задаче графика вознаграждения. J. Neurosci. 33, 3477–3491. DOI: 10.1523 / JNEUROSCI.4388-12.2013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Искьердо, А., Карлос, К., Острандер, С., Родригес, Д., Макколл-Крэддольф, А., Ягник, Г. и др. (2012). Нарушение обучения вознаграждению и сохранная мотивация после истощения серотонина у крыс. Behav. Brain Res. 233, 494–499. DOI: 10.1016 / j.bbr.2012.05.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Якобсен, Дж. П. Р., Медведев, И. О., Карон, М. Г. (2012). Теория депрессии с дефицитом 5-HT: перспективы с натуралистической модели дефицита 5-HT, триптофангидроксилазы 2Arg439His, нокаутирующей мышь. Philos. Пер. R. Soc. Лондон. B Biol. Sci. 367, 2444–2459. DOI: 10.1098 / rstb.2012.0109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джоу, Т. К., Гейслер, С., Маринелли, М., Дегармо, Б. А., и Зам, Д. С. (2009). Мезопонтинное ростромедиальное тегментальное ядро: структура, нацеленная на боковые габенулы, которые проецируются на вентральную область покрышки Tsai и компактную черную субстанцию. J. Comp. Neurol. 513, 566–596. DOI: 10.1002 / cne.21891
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Léger, L. и Wiklund, L. (1982). Распределение и количество тел индоламиновых клеток в стволе мозга кошки, определенные с помощью флуоресцентной гистохимии Falck-Hillarp. Brain Res. Бык. 9, 245–251. DOI: 10.1016 / 0361-9230 (82)
-xPubMed Аннотация | CrossRef Полный текст | Google Scholar
Лейтон, М., Буало, И., Бекельфат, К., Диксич, М., Бейкер, Г., и Дагер, А. (2002).Вызванное амфетамином увеличение внеклеточного дофамина, отсутствие лекарств и стремление к новизне исследование ПЭТ / [11C] раклоприда у здоровых мужчин. Нейропсихофармакология 27, 1027–1035. DOI: 10.1016 / s0893-133x (02) 00366-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Li, Y., Zhong, W., Wang, D., Feng, Q., Liu, Z., Zhou, J., et al. (2016). Серотониновые нейроны в ядре спинного шва кодируют сигналы вознаграждения. Нат. Commun. 7: 10503. DOI: 10.1038 / ncomms10503
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю Р., Джолас, Т., и Агаджанян, Г. (2000). Рецепторы серотонина 5-HT 2 активируют локальные ингибирующие ГАМК входы в серотонинергические нейроны дорсального ядра шва. Brain Res. 873, 34–45. DOI: 10.1016 / s0006-8993 (00) 02468-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю, З., Чжоу, Дж., Ли, Ю., Ху, Ф., Лу, Ю., Ма, М., и др. (2014). Нейроны дорсального шва сигнализируют о вознаграждении через 5-HT и глутамат. Нейрон 81, 1360–1374. DOI: 10.1016 / j.neuron.2014.02.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Macoveanu, J., Hornboll, B., Elliott, R., Erritzoe, D., Paulson, O.B, Siebner, H., et al. (2013). Рецепторы серотонина 2А, циталопрам и истощение триптофана: мультимодальное визуализационное исследование их взаимодействия во время ингибирования ответа. Нейропсихофармакология 38, 996–1005. DOI: 10.1038 / npp.2012.264
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Марцинкевч, К.A., Mazzone, C.M., D’Agostino, G., Halladay, L.R., Hardaway, J.A., DiBerto, J.F. и др. (2016). Серотонин задействует цепь, вызывающую тревогу и страх, в расширенной миндалине. Природа 537, 97–101. DOI: 10.1038 / природа19318
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мэтьюз, Т. А., Феделе, Д. Э., Коппелли, Ф. М., Авила, А. М., Мерфи, Д. Л., и Эндрюс, А. М. (2004). Дозозависимые генные изменения экстранейронального серотонина, но не дофамина, у мышей со сниженной экспрессией переносчика серотонина. J. Neurosci. Методы 140, 169–181. DOI: 10.1016 / j.jneumeth.2004.05.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мацумото, Х., Тиан, Дж., Учида, Н., и Ватабе-Учида, М. (2016). Дофаминовые нейроны среднего мозга сигнализируют об отвращении в зависимости от контекста вознаграждения. Элиф 5: e17328. DOI: 10.7554 / eLife.17328
PubMed Аннотация | CrossRef Полный текст | Google Scholar
МакКейб К., Мисхор З., Коуэн П. Дж. И Хармер К.Дж. (2010). Снижение нейронной обработки отталкивающих и полезных стимулов во время лечения селективным ингибитором обратного захвата серотонина. Biol. Психиатрия 67, 439–445. DOI: 10.1016 / j.biopsych.2009.11.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
McDevitt, R.A., Tiran-Cappello, A., Shen, H., Balderas, I., Britt, J.P., Marino, R.A.M, et al. (2014). Серотонинергические и несеротонергические проекционные нейроны спинного шва: различное участие в схеме вознаграждения. Cell Rep. 8, 1857–1869. DOI: 10.1016 / j.celrep.2014.08.037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Менегас В., Бабаян Б. М., Учида Н. и Ватабе-Учида М. (2017). Противоположная инициализация для новых сигналов в передаче сигналов дофамина в вентральном и заднем полосатом теле у мышей. Элиф 6: e21886. DOI: 10.7554 / eLife.21886
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Miliaressis, E.R., Bouchard, A., и Якобовиц, Д. М. (1975). Сильная положительная награда в срединном шве: специфическое ингибирование пара-хлорфенилаланином. Brain Res. 98, 194–201. DOI: 10.1016 / 0006-8993 (75) -1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миядзаки К. В., Миядзаки К. и Доя К. (2012). Активация серотониновых нейронов дорсального шва необходима для ожидания отложенного вознаграждения. J. Neurosci. 32, 10451–10457. DOI: 10.1523 / JNEUROSCI.0915-12.2012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миядзаки, К., Миядзаки, К. В., и Доя, К. (2012). Роль серотонина в регуляции терпения и импульсивности. Мол. Neurobiol. 45, 213–224. DOI: 10.1007 / s12035-012-8232-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миядзаки К. В., Миядзаки К., Танака К. Ф., Яманака А., Такахаши А., Табучи С. и др. (2014). Оптогенетическая активация серотониновых нейронов дорсального шва усиливает терпение к будущим вознаграждениям. Curr. Биол. 24, 2033–2040.DOI: 10.1016 / j.cub.2014.07.041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Накамура, К., Мацумото, М., и Хикосака, О. (2008). Зависимая от вознаграждения модуляция нейрональной активности в ядре дорсального шва приматов. J Neurosci. 28, 5331–5343. DOI: 10.1523 / JNEUROSCI.0021-08.2008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Огава, С. К., Коэн, Дж. Ю., Хван, Д., Учида, Н., и Ватабе-Учида, М. (2014). Организация моносинаптических входов в нейромодуляторные системы серотонина и дофамина. Cell Rep. 8, 1105–1118. DOI: 10.1016 / j.celrep.2014.06.042
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Олдс, М. Э. и Ювайлер, А. (1992). Эффекты острого и хронического фенфлурамина на самостимуляцию и ее облегчение амфетамином. евро. J. Pharmacol. 216, 363–372. DOI: 10.1016 / 0014-2999 (92) -4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Palminteri, S., Clair, A.-H., Mallet, L., and Pessiglione, M.(2012). Подобное улучшение обучения вознаграждению и наказанию ингибиторами обратного захвата серотонина при обсессивно-компульсивном расстройстве. Biol. Психиатрия 72, 244–250. DOI: 10.1016 / j.biopsych.2011.12.028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Pollak Dorocic, I., Fürth, D., Xuan, Y., Johansson, Y., Pozzi, L., Silberberg, G., et al. (2014). Полный мозговой атлас входов в серотонинергические нейроны дорсального и срединного ядер шва. Нейрон 83, 663–678.DOI: 10.1016 / j.neuron.2014.07.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Qi, J., Zhang, S., Wang, H.-L., Wang, H., de Jesus Aceves, Buendia, J., Hoffman, A.F., et al. (2014). Глутаматергическое вознаграждение поступает от дорсального шва к дофаминовым нейронам вентральной тегментальной области. Нат. Commun. 5: 5390. DOI: 10.1038 / ncomms6390
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Робинсон, О. Дж., Коулс, Р., Саакян, Б.J. (2012). Истощение триптофана запрещает наказание, но не предсказывает вознаграждение: последствия для устойчивости. Психофармакология 219, 599–605. DOI: 10.1007 / s00213-011-2410-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Роджерс, Р. Д., Танбридж, Э. М., Бхагвагар, З., Древец, В. К., Саакян, Б. Дж., И Картер, С. С. (2002). Истощение триптофана изменяет процесс принятия решений здоровыми добровольцами за счет изменения обработки сигналов вознаграждения. Нейропсихофармакология 28, 153–162.DOI: 10.1038 / sj.npp.1300001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ройзер, Дж. П., Блэквелл, А. Д., Коулс, Р., Кларк, Л., Рубинштейн, Д. К., Роббинс, Т. В. и др. (2006). Полиморфизм переносчика серотонина опосредует уязвимость к потере побудительной мотивации после острого истощения триптофана. Нейропсихофармакология 31, 2264–2272. DOI: 10.1038 / sj.npp.1301055
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рыгула, Р., Кларк, Х. Ф., Кардинал, Р. Н., Кокрофт, Дж. Дж., Ся, Дж., Далли, Дж. У. и др. (2015). Роль центрального серотонина в ожидании положительных и карающих результатов: эффекты избирательного миндалевидного тела или орбитофронтального истощения 5-HT. Cereb. Cortex 25, 3064–3076. DOI: 10.1093 / cercor / bhu102
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сакс Б. Д., Ни, Дж. Р., Карон, М. Г. (2015). Дефицит 5-HT головного мозга увеличивает уязвимость к стрессу и ухудшает антидепрессивный ответ после психосоциального стресса. Proc. Natl. Акад. Sci. U S A 112, 2557–2562. DOI: 10.1073 / pnas.1416866112
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сандерс, А.С., Хуссейн, А.Дж., Хен, Р., и Чжуан, X. (2007). Хроническая блокада или конститутивная делеция транспортера серотонина снижает оперантную реакцию на пищевое вознаграждение. Нейропсихофармакология 32, 2321–2329. DOI: 10.1038 / sj.npp.1301368
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шолль, Дж., Коллинг, Н., Нелиссен, Н., Браунинг, М., Рашворт, М. Ф. С., и Хармер, К. Дж. (2017). Помимо отрицательной валентности: 2-недельное введение серотонинергического антидепрессанта усиливает сигналы обучения как вознаграждения, так и усилий. PLoS Biol. 15: e2000756. DOI: 10.1371 / journal.pbio.2000756
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Скотт, М. М., Крюгер, К. К., Денерис, Э. С. (2005). Дифференциально ауторегулируемая область энхансера pet-1 является критической мишенью транскрипционного каскада, который управляет развитием серотониновых нейронов. J. Neurosci. 25, 2628–2636. DOI: 10.1523 / jneurosci.4979-04.2005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сего, К., Гонсалвес, Л., Лима, Л., Фуриго, И. К., Донато, Дж. Мл., И Мецгер, М. (2014). Боковая габенула и ростромедиальное тегментальное ядро иннервируют нейрохимически различные подразделения ядра дорсального шва у крысы. J. Comp. Neurol. 522, 1454–1484. DOI: 10.1002 / cne.23533
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сеймур, Б., Доу Н.Д., Ройзер Дж. П., Даян П. и Долан Р. (2012). Серотонин выборочно модулирует ценность вознаграждения при принятии решений человеком. J. Neurosci. 32, 5833–5842. DOI: 10.1523 / jneurosci.0053-12.2012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Субри, П. (1986). Согласование роли центральных нейронов серотонина в поведении человека и животных. Behav. Brain Sci. 9, 319–335. DOI: 10.1017 / s0140525x00022871
CrossRef Полный текст | Google Scholar
Стубер, Г.Д., Хнаско, Т. С., Бритт, Дж. П., Эдвардс, Р. Х. и Бончи, А. (2010). Дофаминергические окончания в прилежащем ядре, но не в глутамате кореазы спинного стриатума. J. Neurosci. 30, 8229–8233. DOI: 10.1523 / jneurosci.1754-10.2010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Танака, С. К., Доя, К., Окада, Г., Уэда, К., Окамото, Ю. и Ямаваки, С. (2004). Предсказание ближайшего и будущего вознаграждения по-разному задействует петли кортико-базальных ганглиев. Нат. Neurosci. 7, 887–893. DOI: 10.1038 / nn1279
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Танака, С.С., Швайгхофер, Н., Асахи, С., Шишида, К., Окамото, Ю., Ямаваки, С., и др. (2007). Серотонин по-разному регулирует краткосрочные и долгосрочные прогнозы вознаграждения в вентральном и дорсальном полосатом теле. PLoS One 2: e1333. DOI: 10.1371 / journal.pone.0001333
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Танака, С.К., Шишида, К., Швайгхофер, Н., Окамото, Ю., Ямаваки, С., и Доя, К. (2009). Серотонин влияет на связь неблагоприятных исходов с прошлыми действиями. J. Neurosci. 29, 15669–15674. DOI: 10.1523 / jneurosci.2799-09.2009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тансер, М., и Йохансон, К.-Э. (2003). Усиливающие, субъективные и физиологические эффекты MDMA у людей: сравнение с d-амфетамином и mCPP. Зависимость от наркотиков и алкоголя. 72, 33–44.DOI: 10.1016 / s0376-8716 (03) 00172-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Tecuapetla, F., Patel, J. C., Xenias, H., English, D., Tadros, I., Shah, F., et al. (2010). Передача глутаматергических сигналов мезолимбическими дофаминовыми нейронами в прилежащем ядре. J. Neurosci. 30, 7105–7110. DOI: 10.1523 / JNEUROSCI.0265-10.2010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ульспергер М., Фишер А.Г., Нигбур Р. и Эндрасс Т.(2014). Нейронные механизмы и временная динамика мониторинга производительности. Trends Cogn. Sci. 18, 259–267. DOI: 10.1016 / j.tics.2014.02.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван дер Кой, Д., Фибигер, Х.С., и Филлипс, А.Г. (1978). Анализ самостимуляции спинного и срединного шва: эффекты пара-хлорфенилаланина. Pharmacol. Biochem. Behav. 8, 441–445. DOI: 10.1016 / 0091-3057 (78)
-7PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уокер, С.К., Роббинс, Т. В., и Робертс, А. С. (2009). Дифференциальный вклад дофамина и серотонина в функцию орбитофронтальной коры у мартышек. Cereb. Cortex 19, 889–898. DOI: 10.1093 / cercor / bhn136
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уорден, М. Р., Селимбейоглу, А., Мирзабеков, Дж. Дж., Ло, М., Томпсон, К. Р., Ким, С.-Й. и др. (2013). Нейрональная проекция префронтальной коры и ствола мозга, которая контролирует реакцию на поведенческий вызов. Природа 492, 428–432. DOI: 10.1038 / природа11617
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Watabe-Uchida, M., Zhu, L., Ogawa, S.K., Vamanrao, A., and Uchida, N. (2012). Картирование всего мозга прямых входов в дофаминовые нейроны среднего мозга. Нейрон 74, 858–873. DOI: 10.1016 / j.neuron.2012.03.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ви, С., Андерсон, К. Г., Бауман, М. Х., Ротман, Р. Б., Блаф, Б.Э., и Вулвертон, В. Л. (2005). Связь между серотонинергической активностью и усиливающими эффектами ряда аналогов амфетамина. J. Pharmacol. Exp. Ther. 313, 848–854. DOI: 10.1124 / jpet.104.080101
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wee, S., and Woolverton, W. L. (2006). Самостоятельное введение смесей фенфлурамина и амфетамина макаками-резусами. Pharmacol. Biochem. Behav. 84, 337–343. DOI: 10.1016 / j.pbb.2006.05.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вайсборд, Б., Рен, Дж., ДеЛоач, К. Э., Гентнер, К. Дж., Миямичи, К., и Луо, Л. (2014). Пресинаптические партнеры серотонинергических и ГАМКергических нейронов дорсального шва. Нейрон 83, 645–662. DOI: 10.1016 / j.neuron.2014.06.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вудс, Дж. Х., и Тессел, Р. Э. (1974). Фенфлурамин: конгенер амфетамина, который не поддерживает прием наркотиков у макак-резусов. Science 185, 1067–1069. DOI: 10.1126 / science.185.4156.1067
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Worbe, Y., Palminteri, S., Savulich, G., Daw, N. D., Fernandez-Egea, E., Robbins, T. W., et al. (2016). Валентно-зависимое влияние истощения серотонина на стратегию выбора, основанную на модели. Мол. Психиатрия 21, 624–629. DOI: 10.1038 / mp.2015.46
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уивелл, К.Л. и Берридж К. К. (2000). Амфетамин Intra-accumbens увеличивает выраженность обусловленного стимула сахарозного вознаграждения: усиление «желания» вознаграждения без усиления «симпатии» или усиления реакции. J. Neurosci. 20, 8122–8130.
PubMed Аннотация | Google Scholar
Ян Л.-М., Ху Б., Ся Ю.-Х., Чжан Б.-Л. и Чжао Х. (2008). Боковые поражения габенулы улучшают поведенческую реакцию у депрессивных крыс за счет повышения уровня серотонина в ядре спинного шва. Behav. Brain Res. 188, 84–90. DOI: 10.1016 / j.bbr.2007.10.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янг, С. Н. (1996). Поведенческие эффекты диетических предшественников нейромедиаторов: основные и клинические аспекты. Neurosci. Biobehav. Ред. 20, 313–323. DOI: 10.1016 / 0149-7634 (95) 00022-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжоу, Дж., Цзя, К., Фэн, К., Бао, Дж., И Ло, М. (2015). Предполагаемое кодирование сигналов вознаграждения спинного шва орбитофронтальной корой. J. Neurosci. 35, 2717–2730. DOI: 10.1523 / jneurosci.4017-14.2015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжоу, Л., Лю, М. З., Ли, К., Дэн, Дж., Му, Д., и Сунь, Ю. Г. (2017). Организация функциональных цепей дальнего действия, контролирующих активность серотонинергических нейронов в ядре дорсального шва. Cell Rep. 18, 3018–3032. DOI: 10.1016 / j.celrep.2017.02.077
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Как МДМА воздействует на мозг?
Влияние МДМА на серотонин, дофамин и норэпинефрин.МДМА увеличивает уровни этих нейромедиаторов в синапсе, усиливая их высвобождение из нервных окончаний и / или ингибируя их обратный захват.
MDMA влияет на мозг, увеличивая активность по крайней мере трех нейромедиаторов (химических посредников клеток мозга): серотонина, 89,90 дофамина и норадреналина. 91 Как и другие амфетамины, МДМА усиливает высвобождение этих нейромедиаторов 89–92 и / или блокирует их обратный захват, 93,94 , что приводит к увеличению уровней нейротрансмиттеров в синаптической щели (пространство между нейронами в синапсе).
МДМА вызывает большее высвобождение серотонина и норэпинефрина, чем дофамин. 91 Серотонин — нейромедиатор, который играет важную роль в регуляции настроения, сна, боли, аппетита и других форм поведения. Избыточное высвобождение серотонина под действием МДМА, вероятно, вызывает у людей эффект повышения настроения.
Однако, высвобождая большое количество серотонина, МДМА приводит к тому, что мозг значительно истощает этот важный нейромедиатор, способствуя негативным психологическим последствиям, которые люди могут испытывать в течение нескольких дней после приема МДМА. 95,96
Снижение серотонина в нейронах коры головного мозга после длительного воздействия МДМАЛевая панель — ткань мозга нормальной обезьяны. Средняя и правая панели иллюстрируют потерю серотонин-содержащих нервных окончаний после воздействия МДМА.
Исследования на грызунах и приматах показали, что умеренные и высокие дозы МДМА, принимаемые дважды в день в течение четырех дней, повреждают нервные клетки, содержащие серотонин. 10,12 Приматы, подвергшиеся воздействию МДМА, показали снижение количества серотонинергических нейронов 7 лет спустя, что указывает на то, что некоторое действие МДМА на мозг может быть длительным. 11 МДМА оказывает дополнительное влияние на серотониновую систему. Например, через 1-2 недели после приема МДМА (три или четыре низкие дозы за один день) крысы показали снижение экспрессии транспортера серотонина, 13,97 белка, который позволяет клеткам поглощать и рециркулировать высвободившийся серотонин. . Крысы также показали изменения в экспрессии генов, регулирующих триптофангидроксилазу, фермент, участвующий в синтезе серотонина.
Низкий уровень серотонина связан с плохой памятью и подавленным настроением, 98 , таким образом, эти результаты согласуются с исследованиями на людях, которые показали, что некоторые люди, употребляющие МДМА, регулярно испытывают спутанность сознания, 30 депрессия, 30,99 тревога, паранойя , 30,100 и ухудшение памяти 83,101,102 и процессов внимания. 79 Кроме того, исследования показали, что степень использования МДМА у людей коррелирует со снижением метаболитов серотонина и других маркеров функции серотонина, а также степенью нарушения памяти. 95,101 Кроме того, действие МДМА на норэпинефрин способствует когнитивным нарушениям, 94 эмоциональному возбуждению и эйфории, которая сопровождает употребление МДМА. 7
Исследования изображений мозга с помощью позитронно-эмиссионной томографии (ПЭТ) у людей, которые прекратили употреблять МДМА, показали снижение активности мозга в состоянии покоя в префронтальной, теменной и средневисочной коре, а также в миндалевидном теле, поясной извилине и гиппокампе.Это области мозга, участвующие в обучении, памяти, формировании и обработке эмоций. 103,104 ПЭТ-изображение также показало, что одна малая доза МДМА увеличивает церебральную кровь в вентромедиальной лобной и затылочной коре, а также в нижней височной доле и мозжечке. Он уменьшал церебральный кровоток в моторной и соматосенсорной коре, миндалине, поясной коре, островке и таламусе. Это области мозга, участвующие в формировании и обработке эмоций, поведенческом обучении, а также в сенсорных и моторных функциях. 53 В нескольких исследованиях визуализации изучалось влияние умеренного употребления МДМА на мозг человека, а существующие результаты противоречивы из-за методологических различий между исследованиями. 105 Необходимы дополнительные исследования, чтобы определить, вызваны ли наблюдаемые изменения активности мозга у людей, употребляющих МДМА, МДМА, другими наркотиками или другими общими факторами риска, которые предрасполагают людей к употреблению МДМА.
Кроме того, в большинстве исследований на людях нет поведенческих показателей до начала употребления МДМА, что затрудняет исключение ранее существовавших различий или общих основных факторов риска в группах, которые не связаны с употреблением МДМА. 83,106,107 Такие факторы, как пол, дозировка, частота и интенсивность употребления, возраст начала употребления и использование других наркотиков, а также генетические факторы и факторы окружающей среды могут играть роль в некоторых когнитивных нарушениях, связанных с МДМА. следует принимать во внимание при изучении воздействия МДМА на человека.

 0 — 440.0
0 — 440.0 0 — 520.0
0 — 520.0